🔹 Pengertian Transfer Elektron
Transfer elektron adalah proses perpindahan elektron dari satu zat ke zat lain dalam suatu reaksi kimia.
Proses ini merupakan inti dari reaksi redoks (reduksi–oksidasi).
-
Zat yang melepaskan elektron disebut pereduksi (mengalami oksidasi).
-
Zat yang menerima elektron disebut pengoksidasi (mengalami reduksi).
🔹 Prinsip Dasar Transfer Elektron
Dalam suatu reaksi redoks:
-
Elektron tidak pernah hilang, hanya berpindah dari satu spesies ke spesies lain.
-
Jumlah elektron yang dilepas = jumlah elektron yang diterima (hukum kekekalan muatan).
📘 Contoh sederhana:
Zn+Cu2+→Zn2++Cu\text{Zn} + \text{Cu}^{2+} \rightarrow \text{Zn}^{2+} + \text{Cu}
Penjelasan:
-
Zn → Zn²⁺ + 2e⁻ → terjadi oksidasi (melepaskan elektron)
-
Cu²⁺ + 2e⁻ → Cu → terjadi reduksi (menerima elektron)
➡️ Elektron berpindah dari seng (Zn) ke ion tembaga (Cu²⁺).
🔹 Jenis-jenis Transfer Elektron
-
Langsung:
Elektron berpindah langsung antara dua zat yang berinteraksi secara langsung.
Contoh: reaksi antara logam dengan ion logam lain. -
Tidak langsung (melalui penghantar):
Elektron mengalir melalui konduktor atau elektroda (misalnya dalam sel elektrokimia).
Contoh: reaksi pada sel galvanik atau sel elektrolisis.
🔹 Peran Transfer Elektron dalam Kehidupan dan Teknologi
Transfer elektron sangat penting dalam banyak proses kimia dan biologis, antara lain:
-
🔋 Sel galvanik / baterai: menghasilkan energi listrik dari reaksi redoks.
-
⚡ Sel elektrolisis: menggunakan listrik untuk memicu reaksi kimia.
-
🌿 Fotosintesis: elektron berpindah dari air ke CO₂ untuk membentuk glukosa.
-
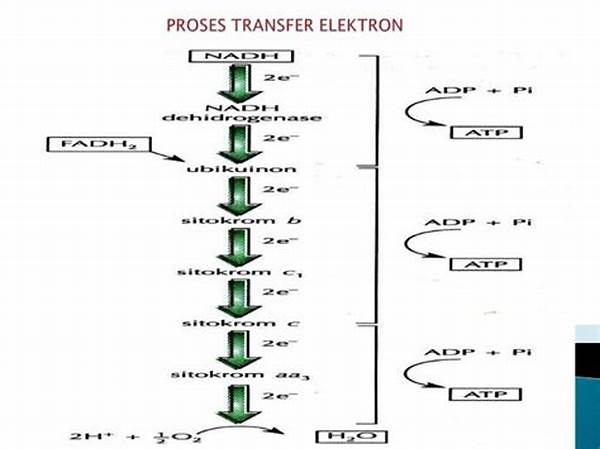
❤️ Respirasi seluler: elektron berpindah dari molekul makanan ke oksigen menghasilkan energi (ATP).
-
⚙️ Korosi logam: elektron berpindah dari logam ke oksigen dan air membentuk karat.
🔹 Kesimpulan
| Aspek | Keterangan |
|---|---|
| Definisi | Perpindahan elektron antar zat dalam reaksi redoks |
| Zat yang melepaskan elektron | Pereduksi (mengalami oksidasi) |
| Zat yang menerima elektron | Pengoksidasi (mengalami reduksi) |
| Ciri utama | Terjadi perubahan bilangan oksidasi |
| Penerapan | Baterai, fotosintesis, respirasi, korosi, elektrolisis |