Abstrak
Baterai ion natrium (SIB) telah menarik perhatian besar karena kemiripan elektrokimianya dengan baterai ion litium. Salah satu pendekatan untuk memajukan sistem SIB melibatkan penggunaan senyawa aktif redoks sebagai bahan katode yang berkelanjutan. Senyawa organik menawarkan keuntungan dari sifat elektrokimia yang dapat disetel, yang dapat dimodulasi dengan mengubah struktur molekulnya. Dalam penelitian ini, 2,6-diaminoantrakuinon (2,6-DAAQ) yang tersedia secara komersial diteliti sebagai bahan katode potensial untuk SIB. Kemampuan penyimpanan ion natriumnya diteliti melalui kombinasi pengukuran elektrokimia dan perhitungan teori fungsi kerapatan (DFT). Selain itu, penyisipan dua ion Na + ke dalam katode 2,6-DAAQ dianalisis melalui spektroskopi FT-IR ATR ex situ. Hasilnya menunjukkan bahwa gugus karbonil berpartisipasi dalam proses redoks selama siklus pengisian-pengosongan. Katode 2,6-DAAQ juga menunjukkan stabilitas siklus dan kemampuan laju yang sangat baik, yang dapat dikaitkan dengan perilaku kapasitifnya yang dominan. Secara keseluruhan, 2,6-DAAQ menunjukkan penyimpanan ion natrium yang reversibel, menyoroti potensinya sebagai katoda organik yang stabil untuk SIB generasi berikutnya.
PERKENALAN
Karena meningkatnya permintaan untuk sistem penyimpanan energi canggih, baterai ion natrium (SIB) telah muncul sebagai alternatif yang layak untuk baterai ion litium (LIB). SIB memiliki proses elektrokimia yang sama dengan LIB dan memiliki cadangan natrium yang lebih besar daripada litium, serta biaya yang rendah, sehingga menjadi kandidat yang menarik untuk sistem penyimpanan energi generasi berikutnya. Oleh karena itu, penelitian ekstensif telah difokuskan pada peningkatan kinerja penyimpanan energi dan kelayakan ekonomi SIB selama beberapa dekade terakhir. Salah satu strateginya adalah memperkenalkan senyawa organik yang aktif terhadap redoks sebagai bahan katode baru. Katode organik diharapkan dapat mengurangi ketergantungan pada bahan katode anorganik yang ada karena kemampuan penyesuaian struktural, keberlanjutan, dan keramahan lingkungannya. Sifat elektrokimia senyawa organik dipengaruhi oleh lingkungan elektroniknya dalam struktur molekuler, sehingga dapat dimodifikasi dan dioptimalkan dengan mengubah struktur kimianya. 1 , 2
Di antara berbagai kelas bahan organik yang aktif terhadap redoks, bahan berbasis kuinon telah dianggap sebagai katode yang menjanjikan untuk SIB tingkat lanjut. Dalam beberapa tahun terakhir, beberapa turunan kuinon seperti benzokuinon, naftokuinon, antrakuinon, dan turunannya termasuk bahan polimer berbasis kuinon telah dipelajari sebagai bahan katode organik yang aktif terhadap redoks untuk SIB. 3 – 9 Katode organik berbasis kuinon ini menunjukkan kapasitas spesifik yang tinggi, tegangan pelepasan yang tinggi, dan reversibilitas redoks yang sangat baik dengan ion Na + . Untuk aplikasi praktis senyawa berbasis kuinon sebagai bahan katode untuk SIB, penting untuk mengidentifikasi senyawa kuinon yang secara struktural sederhana dan tersedia secara komersial. Senyawa tersebut juga harus memiliki aktivitas redoks yang reversibel dengan ion Na + dan siklus hidup jangka panjang.
Dalam penelitian ini, kami memilih 2,6-diaminoantrakuinon (2,6-DAAQ) (Gambar 1 ) sebagai bahan katode organik yang aktif terhadap redoks, karena inti antrakuinonnya yang kuat dan keberadaan gugus amino pendonor elektron. Sifat elektrokimia katode 2,6-DAAQ diteliti melalui serangkaian voltametri siklik (CV) dan uji siklus pengisian-pelepasan galvanostatik. Mekanisme penyimpanan ion Na + dari katode 2,6-DAAQ dianalisis dengan analisis FT-IR ex situ, yang memantau gugus karbonil selama proses pengisian-pelepasan dan dengan simulasi teori fungsi kerapatan (DFT). Pada bagian akhir, perilaku elektrokimia 2,6-DAAQ ditentukan dengan analisis kinetika elektrokimia menggunakan voltamogram siklik yang diperoleh pada laju pemindaian yang berbeda dan diinterpretasikan dalam kaitannya dengan kemampuan pengisian cepatnya. Penelitian ini bertujuan untuk menjelaskan potensi kemampuan penyimpanan ion Na + dari 2,6-DAAQ sebagai bahan katoda canggih untuk SIB.
GAMBAR 1
Buka di penampil gambar
Kekuatan Gambar
Struktur kimia 2,6-DAAQ.
PERCOBAAN
Bahan dan karakterisasi
2,6-Diaminoanthraquinone (2,6-DAAQ, 97%), logam natrium (kubus, mengandung minyak mineral, 99,9% logam jejak), poli(vinilidena fluorida) (PVDF, rata-rata M w ≈534.000 menurut GPC, bubuk), dan N-Metil-2-pirolidon (NMP, reagen ACS, ≥99,0%) dibeli dari Merck. Karbon hitam konduktif (Super P), aluminium foil 20 μm, 1 M NaPF6 dalam dietilen glikol dimetil eter (DEGDME), dan paket perakitan sel koin CR2032 dibeli dari Wellcos Co. Semua bahan kimia yang dibeli digunakan tanpa pemurnian lebih lanjut. Spektroskopi serapan inframerah transformasi Fourier reflektansi total yang dilemahkan (ATR FT-IR) dilakukan menggunakan spektrometer FT-IR Thermo Scientific US/IS5. Semua uji elektrokimia dilakukan dalam rentang potensial 1,0–3,5 V versus Na/Na + dalam setengah sel natrium. Spektroskopi impedansi elektrokimia (EIS) dilakukan dalam rentang frekuensi 1 MHz hingga 100 mHz, menggunakan WonAtech ZIVE SP1. Voltametri siklik (CV) dan uji siklus pengisian-pengosongan galvanostatik dilakukan pada WonAtech WBCS3000S.
Pembuatan setengah sel tipe koin CR2032
Untuk menyiapkan katode 2,6-DAAQ, 50 mg bubuk 2,6-DAAQ komersial sebagai bahan aktif, 40 mg reagen konduktif (Super P), dan 10 mg binder PVDF dicampur dalam mortar akik dengan pelarut NMP. Tinta elektroda yang dihasilkan dilapisi batang pada foil Al setebal 20 μm dan dikeringkan pada suhu 80°C di udara selama satu jam, dan kemudian dalam vakum selama 3 jam. Cakram katode 2,6-DAAQ 10 mm digunakan sebagai elektroda kerja. Logam Na, filter serat mikro kaca (GF/F, Whatman), dan 1 M NaPF6 dalam DEGDME digunakan sebagai elektroda lawan/referensi, pemisah, dan elektrolit, masing-masing. Semua setengah sel natrium tipe koin CR2032 dirakit dalam kotak sarung tangan berisi Ar murni (O2 , H2O < 0,1 ppm).
Perhitungan berdasarkan teori fungsional kepadatan
Semua perhitungan teori fungsi kerapatan (DFT) dilakukan menggunakan fungsi B3LYP dengan basis set 6–311 + G(d,p), yang diterapkan dalam Gaussian 16. 10 Energi bebas solvasi diperoleh menggunakan pendekatan SMD (model solvasi berdasarkan kerapatan), menggunakan konstanta dielektrik statis (ε EPS = 7,34) dan konstanta dielektrik optik (ε EPSINF = 1,9873) untuk mensimulasikan efek solvasi elektrolit DEGDME. Penentu lokasi orbital terlokalisasi-π (LOL-π) dihitung menggunakan program Multiwfn 3.8. 11 , 12
HASIL DAN PEMBAHASAN
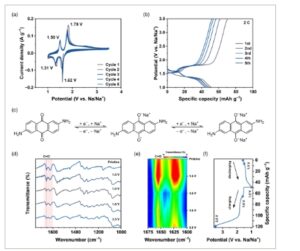
Untuk menyelidiki kemampuan penyimpanan ion Na + dari 2,6-DAAQ dalam sistem SIB, 2,6-DAAQ komersial dibuat menjadi setengah sel natrium tipe koin CR2032 dan dianalisis dengan berbagai pengukuran elektrokimia. Gambar 2a mengilustrasikan voltamogram siklik katode 2,6-DAAQ untuk lima siklus awal dalam jendela potensial 1,0–3,5 V versus elektroda referensi Na/Na + . Katode 2,6-DAAQ menunjukkan reversibilitas yang jelas untuk penyisipan dan ekstraksi ion Na + selama lima siklus awal dengan dua pasangan redoks. Satu pasangan pada sekitar 1,71 V sesuai dengan proses redoks antara 2,6-DAAQ dan 2,6-DAAQ mono-sodiasi, sedangkan yang lain pada sekitar 1,41 V sesuai dengan transisi antara 2,6-DAAQ mono- dan di-sodiasi. Selain itu, siklus pengisian-pengosongan galvanostatik dilakukan untuk menunjukkan kinerja penyimpanan ion Na + praktis dari katode 2,6-DAAQ. Gambar 2b menggambarkan profil tegangan pengisian-pengosongan galvanostatik untuk lima siklus awal pada 2C (1C = 225 mA g −1 ). Plateau kapasitas untuk katode 2,6-DAAQ muncul pada sekitar 1,69 dan 1,44 V. Plateau ini diamati pada tegangan yang sama dengan pasangan redoks dalam uji voltametri siklik (CV). Ini menunjukkan bahwa proses redoks dari 2,6-DAAQ menjadi 2,6-DAAQ mono-sodiasi, dan dari 2,6-DAAQ mono-sodiasi menjadi 2,6-DAAQ di-sodiasi terjadi, masing-masing. Parameter siklus terperinci (nomor siklus, kapasitas pengisian dan pengosongan [mAh g −1 ]) adalah sebagai berikut: (1, 70, 49), (2, 62, 51), (3, 57, 48), (4, 54, 46), dan (5, 52, 44).
GAMBAR 2
Buka di penampil gambar
Kekuatan Gambar
(a) Lima voltamogram siklik awal pada 0,1 mV s −1 . (b) Lima profil tegangan pengisian-pelepasan galvanostatik awal pada 2C. (c) Mekanisme sodiasi yang diusulkan untuk katode 2,6-DAAQ. (d) Analisis FT-IR ATR eks situ untuk katode 2,6-DAAQ pada berbagai status pengisian. (e) Peta warna analisis FT-IR ATR eks situ yang diperluas dari 1600 hingga 1675 cm −1 . (f) Profil tegangan pengisian-pelepasan dengan titik perekaman FT-IR ATR ditunjukkan.
Gambar 2c mengilustrasikan mekanisme sodiasi yang diusulkan dari katode 2,6-DAAQ, yang melibatkan penyisipan dua ion Na + . Selama pelepasan muatan, gugus C=O dari perancah antrakuinon direduksi untuk membentuk ikatan C–O–Na, yang dioksidasi kembali secara reversibel menjadi gugus karbonil setelah pengisian ulang. Transformasi redoks ini terjadi secara berurutan, seperti yang ditunjukkan pada Gambar 2a,b , dan konsisten dengan laporan sebelumnya tentang bahan katode berbasis antrakuinon untuk SIB.
Untuk mendapatkan wawasan lebih jauh mengenai mekanisme sodiasi dan desodiasi, analisis ATR FT-IR ex situ dilakukan (Gambar 2d–f ). Katoda 2,6-DAAQ pada empat status pengisian berbeda disiapkan dengan membongkar setengah sel natrium yang dikosongkan hingga 1,5 V, dikosongkan penuh hingga 1,0 V, diisi ulang hingga 1,6 V, dan diisi ulang penuh hingga 3,5 V, masing-masing, seperti yang ditandai pada Gambar 2f . Setelah pengeringan vakum tanpa perlakuan lebih lanjut, permukaan sampel yang disiapkan, juga termasuk katoda 2,6-DAAQ murni, dianalisis dengan spektroskopi ATR FT-IR. Gambar 2d menampilkan spektrum ATR FT-IR dari katoda 2,6-DAAQ dalam berbagai tingkat pengisian. Untuk mengidentifikasi perubahan pada pita serapan C=O, tampilan peta warna yang diperluas dari daerah spektral antara 1600 dan 1675 cm −1 disajikan pada Gambar 2e . Hilangnya dan munculnya kembali puncak serapan pada 1654 cm −1 yang reversibel , yang sesuai dengan gugus karbonil dari 2,6-DAAQ, mengonfirmasi aktivitas redoks gugus C=O selama uji siklus pengisian-pengosongan. Perubahan informasi spektral ini menunjukkan transformasi reversibel antara ikatan C=O dan ikatan C–O–Na dan pemulihan berikutnya setelah desodiasi.
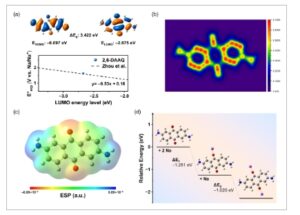
Simulasi DFT dilakukan untuk memahami perilaku elektrokimia katode 2,6-DAAQ dalam sistem SIB. Orbital molekul tertinggi yang terisi (HOMO) dan orbital molekul terendah yang tidak terisi (LUMO) dari 2,6-DAAQ divisualisasikan dalam Gambar 3a . Di sini, tingkat energi HOMO dan LUMO masing-masing adalah -6,097 dan -2,675 eV, dan celah pita mereka sama dengan 3,422 eV. Zhou et al. mengembangkan model regresi untuk memprediksi potensi reduksi bahan berbasis kuinon berdasarkan tingkat energi LUMO mereka (dihitung pada tingkat B3LYP dalam fase gas). 13 Menariknya, ketika potensi reduksi terukur sebesar 1,62 V versus Na/Na + diplotkan terhadap tingkat energi LUMO fase gas yang dihitung DFT (Gambar 3a , panel bawah), hasil kami juga sesuai dengan model regresi yang dilaporkan sebelumnya ini. Gambar 3b menampilkan peta berwarna dari penentu lokasi orbital terlokalisasi-π (LOL-π), yang menunjukkan bahwa elektron-π terkonjugasi terdelokalisasi di seluruh struktur planar 2,6-DAAQ. Hal ini dapat meningkatkan konduktivitas elektronik yang mendukung pengangkutan muatan yang efisien selama proses redoks. Peta potensial elektrostatik (ESP) (Gambar 3c ) mengungkapkan bahwa muatan negatif terkonsentrasi di sekitar atom oksigen karbonil, yang berfungsi sebagai tempat koordinasi yang menguntungkan bagi ion Na + , meningkatkan pengikatan ion Na + selektif . Gambar 3d mengilustrasikan nilai energi total dan struktur DFT yang dioptimalkan dari 2,6-DAAQ, 2,6-DAAQ mono-sodiasi dan di-sodiasi, yang menggabungkan efek solvasi pelarut DEGDME. Di sini, perubahan energi total untuk penyisipan ion Na + pertama dan kedua (ΔE 1 dan ΔE 2 ) masing-masing adalah -1,251 dan -1,020 eV. Proses eksergonik ini menunjukkan bahwa kedua ion Na + dapat disisipkan secara menguntungkan dan berurutan ke dalam 2,6-DAAQ selama proses reduksi. Lebih jauh, tren energi ini mengonfirmasi kelayakan mekanisme redoks dua elektron, yang konsisten dengan dua pasang puncak redoks yang diamati dalam kurva CV eksperimental yang ditunjukkan pada Gambar 2a .
GAMBAR 3
Buka di penampil gambar
Kekuatan Gambar
(a) Distribusi HOMO dan LUMO serta tingkat energinya, dan potensi pelepasan yang diukur secara eksperimen diplotkan terhadap energi LUMO, dengan perbandingan terhadap model regresi yang dilaporkan sebelumnya (Zhou et al.). (b) Pemetaan penentu lokasi orbital-π (LOL-π) yang terlokalisasi. (c) Pemetaan potensi elektrostatik (ESP), yang menunjukkan distribusi spasial daerah yang kaya elektron (merah) dan daerah yang kekurangan elektron (biru). (d) Struktur yang dioptimalkan dan total perubahan energi 2,6-DAAQ dan 2,6-DAAQ yang tersodiasi.
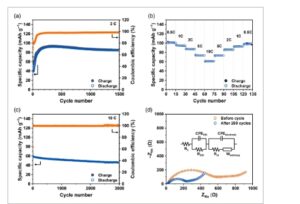
Gambar 4 menampilkan kinerja siklus katode 2,6-DAAQ dengan melakukan uji siklus pengisian-pengosongan galvanostatik pada berbagai kerapatan arus. Pada kerapatan arus 2C (Gambar 4a ), katode 2,6-DAAQ menghasilkan kapasitas reversibel 84 mAh g −1 selama 1500 siklus dengan efisiensi coulombik rata-rata (CE) sebesar 97,3%. Gambar 4b menunjukkan kemampuan laju katode 2,6-DAAQ pada berbagai kerapatan arus. Diukur setelah 200 siklus pada 2C untuk berada dalam status aktif katode 2,6-DAAQ. Kinerja siklus pengisian-pengosongan galvanostatik keseluruhan, termasuk data yang ditunjukkan pada Gambar 4b,c , disediakan pada Gambar S1 , Informasi Pendukung. Kepadatan arus diubah secara berurutan dari 0,5 ke 10C untuk setiap 15 siklus dan secara bertahap dikembalikan ke 0,5C lagi. Kapasitas reversibel ke-15 pada setiap kepadatan arus adalah 101, 95, 87, 73, 61, 73, 86, 93, dan 100 mAh g −1 , di mana urutan kepadatan arus adalah 0,5, 1, 2, 5, 10, 5, 2, 1, dan 0,5C. Gambar 4c mengilustrasikan kinerja siklus cepat jangka panjang dari katode 2,6-DAAQ. Setelah uji kemampuan laju (Gambar 4b dan S1 ), kinerja siklus pengisian-pengosongan galvanostatik segera diukur pada kepadatan arus tinggi 10C. Setelah beralih dari 0,5C ke 10C, katode mempertahankan kapasitas reversibel sebesar 65 mAh g −1 , dan setelah 3000 siklus, mempertahankan 46 mAh g −1 , menunjukkan stabilitas
GAMBAR 4
Buka di penampil gambar
Kekuatan Gambar
(a) Kinerja siklus pada suhu 2C. (b) Kemampuan laju pada berbagai kerapatan arus mulai dari 0,5C hingga 10C. (c) Kinerja siklus cepat jangka panjang pada suhu 10C. (d) Plot Nyquist sebelum dan sesudah 200 siklus pada suhu 2C. Lihat Gambar S1 untuk data siklus lengkap dan titik pengukuran EIS.
Gambar 4d menggambarkan plot Nyquist dan model rangkaian ekivalen yang sesuai dari katode 2,6-DAAQ sebelum dan setelah 200 siklus pada 2C. Titik-titik spesifik di mana EIS dilakukan ditunjukkan pada Gambar S1 . Sebelum uji siklus, katode 2,6-DAAQ mengungkapkan resistansi transfer muatan (R ct ) sebesar 363 Ω, sedangkan setelah siklus sebesar 257 Ω, yang menunjukkan bahwa peningkatan konduktivitas elektronik terjadi selama siklus pengisian-pelepasan galvanostatik. Peningkatan R ct ini diasumsikan sebagai hasil dari penetrasi molekul elektrolit ke dalam situs bagian dalam katode 2,6-DAAQ. Hasilnya, hal ini mendorong pembangunan jalur yang lebih efisien untuk proses penyimpanan ion Na + , yang mengungkapkan aktivasi kapasitas yang diamati selama siklus awal. 14 , 15
Gambar 4 menunjukkan bahwa katode 2,6-DAAQ menunjukkan stabilitas siklus yang sangat baik dan kemampuan laju yang luar biasa pada berbagai kerapatan arus, bahkan hingga 10C. Namun, seperti yang ditunjukkan pada Gambar 4b , kapasitas reversibel aktualnya hanya mencapai 101 mAh g −1 pada 0,5C, yang secara signifikan lebih rendah daripada kapasitas teoritis sebesar 225 mAh g −1 . Kehilangan kapasitas ini diduga disebabkan oleh fakta bahwa 2,6-DAAQ larut dalam elektrolit DEGDME, seperti yang ditunjukkan pada Gambar S2 . Disarankan bahwa beberapa molekul 2,6-DAAQ dapat larut ke dalam elektrolit selama perakitan sel, yang mengakibatkan berkurangnya jumlah bahan aktif pada elektroda dan, akibatnya, kapasitas reversibel yang lebih rendah. Lebih jauh, dengan mempertimbangkan hasil analisis FT-IR ATR ex situ (Gambar 2d–f ), pita serapan pada 1654 cm −1 menjadi jauh lebih lemah selama proses pelepasan tetapi masih dapat dideteksi dalam keadaan pelepasan penuh, yang menunjukkan bahwa pita tersebut tidak sepenuhnya hilang. Hal ini menunjukkan bahwa beberapa gugus karbonil masih tersisa setelah proses pelepasan, yang menyiratkan bahwa tidak semua molekul 2,6-DAAQ pada elektroda dapat berpartisipasi dalam proses sodiasi, yang mungkin juga berkontribusi pada kapasitas reversibel katode 2,6-DAAQ yang terbatas.
Seperti yang ditunjukkan pada Gambar 5 , analisis kinetika elektrokimia dilakukan untuk menyelidiki lebih lanjut proses penyimpanan ion Na + . Gambar 5a menampilkan kurva CV 2,6-DAAQ pada berbagai laju pindai (0,1–1,0 mV s −1 ). Saat meningkatkan laju pindai, kerapatan arus puncak meningkat tanpa pergeseran, yang menunjukkan polarisasi minimal dan transfer muatan yang efisien. Gambar 5b mengilustrasikan hubungan linier antara logaritma kerapatan arus puncak dan logaritma laju pindai untuk empat puncak redoks (O1, O2, R1, dan R2) yang dianalisis menggunakan Persamaan ( 1 ) dan ( 2 ), 16
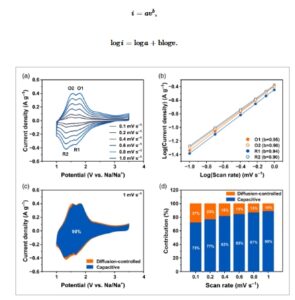
GAMBAR 5
Buka di penampil gambar
Kekuatan Gambar
(a) Kurva CV pada berbagai laju pindai berkisar dari 0,1 hingga 1 mV s −1 . (b) Plot Log (kepadatan arus puncak) versus Log (laju pindai). (c) Kontribusi visual dari proses kapasitif. (d) Rasio kontribusi kapasitif pada setiap laju pindai.
Di sini, i dan v menunjukkan kerapatan arus puncak dan laju pemindaian. Kemiringan setiap garis disebut sebagai nilai- b dan memberikan wawasan tentang mekanisme penyimpanan muatan pada permukaan elektroda. Nilai – b mendekati 0,5 menyiratkan proses yang dikendalikan oleh difusi, sedangkan nilai- b mendekati 1,0 menunjukkan proses yang dikendalikan oleh permukaan (kapasitif). Nilai- b dari semua puncak redoks katode 2,6-DAAQ lebih tinggi dari 0,9 (0,95 untuk O1, 0,90 untuk O2, 0,94 untuk R1, 0,90 untuk R2), yang mengonfirmasi mekanisme penyimpanan muatan yang sebagian besar bersifat kapasitif. Berdasarkan pengamatan ini, metode Dunn digunakan untuk mengekstraksi arus kapasitif secara kuantitatif dari total arus elektrokimia pada setiap laju pemindaian menggunakan Persamaan ( 3 ), 17 , 18
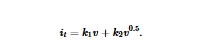
Di sini, i t adalah total kepadatan arus, k 1 v adalah arus kapasitif, dan k 2 v 0,5 adalah arus yang dikendalikan oleh difusi. Gambar 5c memvisualisasikan kontribusi arus kapasitif (wilayah biru) pada laju pindai 1 mV s −1 , yang menunjukkan karakteristik kapasitif yang dominan dibandingkan dengan karakteristik yang dikendalikan oleh difusi. Gambar 5d menunjukkan bahwa katode 2,6-DAAQ memiliki perilaku kapasitif yang berbeda pada berbagai laju pindai, yang menjadi lebih dominan pada laju pindai yang lebih tinggi. Ini berarti bahwa proses redoks katode 2,6-DAAQ terutama diatur oleh penyimpanan muatan kapasitif. Diasumsikan bahwa kemampuan laju yang sangat baik dari katode 2,6-DAAQ dihasilkan dari karakteristik kapasitifnya yang dominan.
KESIMPULAN
Dalam penelitian ini, 2,6-DAAQ komersial dievaluasi sebagai bahan katode organik yang menjanjikan untuk baterai ion natrium generasi berikutnya. Kurva CV dan profil tegangan pengisian-pengosongan galvanostatik menunjukkan bahwa 2,6-DAAQ juga mengungkap proses redoks dua elektron yang menyertai pengenalan dua ion Na + , mirip dengan bahan katode organik berbasis kuinon yang dilaporkan sebelumnya. Proses penyisipan ion Na + ini diamati dengan analisis FT-IR ATR ex situ. Selain itu, perhitungan DFT menunjukkan bahwa 2,6-DAAQ memiliki kemampuan penyimpanan ion natrium yang wajar melalui proses redoks. Dalam uji siklus pengisian-pengosongan galvanostatik, katode 2,6-DAAQ menghasilkan kapasitas reversibel sebesar 84 mAh g −1 setelah 1500 siklus pada 2C. Selain itu, katode 2,6-DAAQ yang diaktifkan menunjukkan stabilitas siklus jangka panjang yang sangat baik, yang menunjukkan retensi kapasitas sebesar 71% selama 3000 siklus. Analisis kinetika elektrokimia menegaskan bahwa kinerja laju yang sangat baik dari katode 2,6-DAAQ disebabkan oleh karakteristik kapasitifnya. Hasilnya, 2,6-DAAQ dianggap sebagai kandidat yang menarik untuk bahan katode organik yang stabil.
