🔹 Pengertian Teori VSEPR
VSEPR merupakan singkatan dari
👉 Valence Shell Electron Pair Repulsion Theory
(Teori Tolakan Pasangan Elektron Kulit Valensi).
Teori ini menjelaskan bahwa:
Bentuk molekul ditentukan oleh gaya tolak-menolak antara pasangan elektron di sekitar atom pusat — baik pasangan elektron ikatan maupun pasangan elektron bebas.
Pasangan elektron akan menempati posisi sejauh mungkin satu sama lain untuk meminimalkan tolakan dan menstabilkan molekul.
🔹 Prinsip Dasar Teori VSEPR
-
Atom pusat memiliki pasangan elektron ikatan (PEI) dan pasangan elektron bebas (PEB).
-
Semakin banyak pasangan bebas, semakin besar gaya tolakannya terhadap pasangan ikatan.
-
Tolakan pasangan elektron:
PEB–PEB > PEB–PEI > PEI–PEI -
Bentuk molekul ditentukan oleh jumlah total pasangan elektron di sekitar atom pusat.
🔹 Langkah Menentukan Bentuk Molekul
-
Tentukan atom pusat (biasanya yang paling sedikit elektronegatif).
-
Hitung jumlah elektron valensi total.
-
Tentukan jumlah pasangan elektron di sekitar atom pusat.
-
Tentukan jumlah pasangan ikatan (PEI) dan pasangan bebas (PEB).
-
Gunakan aturan VSEPR untuk menentukan bentuk molekul dan sudut ikatannya.
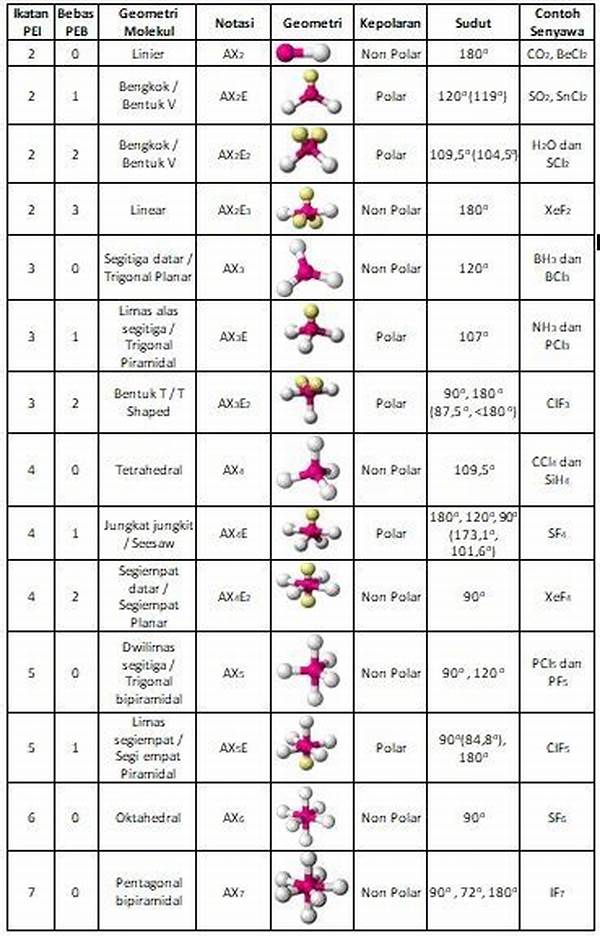
🔹 Macam-Macam Bentuk Molekul Menurut VSEPR
| Jumlah Pasangan Elektron di Sekitar Atom Pusat | Jumlah PEB | Bentuk Geometri Elektron | Bentuk Molekul | Contoh Molekul | Sudut Ikatan |
|---|---|---|---|---|---|
| 2 | 0 | Linear | Linear | BeCl₂, CO₂ | 180° |
| 3 | 0 | Trigonal planar | Segitiga datar | BF₃, SO₃ | 120° |
| 3 | 1 | Trigonal planar | Bentuk V (bengkok) | SO₂ | <120° |
| 4 | 0 | Tetrahedral | Tetrahedral | CH₄ | 109,5° |
| 4 | 1 | Tetrahedral | Piramida trigonal | NH₃ | ~107° |
| 4 | 2 | Tetrahedral | Bentuk V (bengkok) | H₂O | ~104,5° |
| 5 | 0 | Bipiramida trigonal | Bipiramida trigonal | PCl₅ | 90°, 120° |
| 5 | 1 | Bipiramida trigonal | Seesaw (ayunan) | SF₄ | ~90°, ~120° |
| 5 | 2 | Bipiramida trigonal | T-bentuk | ClF₃ | ~90° |
| 5 | 3 | Bipiramida trigonal | Linear | XeF₂ | 180° |
| 6 | 0 | Oktahedral | Oktahedral | SF₆ | 90° |
| 6 | 1 | Oktahedral | Piramida persegi | BrF₅ | ~90° |
| 6 | 2 | Oktahedral | Planar persegi | XeF₄ | 90° |
🔹 Contoh Penjelasan
Molekul air (H₂O):
-
Atom pusat: O
-
Total pasangan elektron = 4 (2 ikatan + 2 bebas)
-
Geometri elektron: Tetrahedral
-
Bentuk molekul: Bentuk V (bengkok)
-
Sudut ikatan ≈ 104,5°
➡️ Pasangan bebas menekan ikatan H–O sehingga sudutnya lebih kecil dari 109,5°.
🔹 Kesimpulan
| Aspek | Keterangan |
|---|---|
| Nama teori | VSEPR (Valence Shell Electron Pair Repulsion) |
| Prinsip utama | Bentuk molekul ditentukan oleh tolakan pasangan elektron |
| Jenis pasangan elektron | Pasangan ikatan (PEI) dan pasangan bebas (PEB) |
| Faktor penentu bentuk | Jumlah total pasangan elektron di sekitar atom pusat |
| Contoh bentuk umum | Linear, trigonal planar, tetrahedral, bipiramida trigonal, oktahedral |