ABSTRAK
Gangguan penyembuhan luka diabetes, komplikasi umum diabetes, memiliki pilihan perawatan klinis yang terbatas dan hasil terapi yang buruk, yang menyebabkan nyeri fisik dan beban psikologis yang signifikan bagi pasien. Penelitian ini bertujuan untuk mempercepat penyembuhan luka dengan memodulasi respons stres seluler, menawarkan strategi terapi baru yang aman dan efisien. Di sini, hidrogel termosensitif poliuretan (SePU) yang mengandung selenium disintesis, dan mekanismenya untuk meningkatkan penyembuhan luka diabetes dengan mengaktifkan respons protein yang tidak terlipat (UPR) dijelaskan. Hidroksibutil kitosan (HBC) menawarkan aplikasi yang lebih nyaman untuk SePU, dengan substitusi hidroksibutilnya yang tinggi memungkinkan hidrogel untuk menjalani transisi sol–gel yang cepat pada suhu fisiologis. Percobaan in vitro menunjukkan bahwa hidrogel termosensitif SePU (SePU/HBC), pada konsentrasi yang tepat, secara signifikan meningkatkan proliferasi, penyebaran, migrasi, dan adhesi fibroblas kulit manusia (HSF), sekaligus menghambat peradangan. Model tikus diabetes in vivo, SePU/HBC menunjukkan efek penyembuhan luka yang signifikan, yang mendorong re-epitelialisasi, pembentukan kolagen, dan pematangan. Studi mekanistik mengungkapkan bahwa SePU/HBC mengurangi stres retikulum endoplasma dalam kondisi hiperglikemia dengan mengaktifkan gen ATF6 yang terkait dengan UPR untuk mengurangi stres retikulum endoplasma (ERS) dan menghambat apoptosis. Studi ini menawarkan strategi baru untuk perawatan luka diabetes menggunakan SePU/HBC, yang mengaktifkan UPR dan menghambat apoptosis, yang menunjukkan aplikasi klinis yang menjanjikan untuk penyembuhan luka.
1 Pendahuluan
Penyembuhan luka yang lambat atau terganggu merupakan komplikasi diabetes yang parah, yang mempengaruhi sekitar 25% pasien di seluruh dunia [ 1 , 2 ]. Penyembuhan luka adalah proses multifase yang kompleks yang melibatkan peradangan, proliferasi, dan remodeling [ 3 – 5 ]. Pada diabetes, sekresi faktor inflamasi yang berlebihan memperpanjang peradangan, menghambat transisi ke fase selanjutnya [ 6 ]. Spesies oksigen reaktif (ROS) yang meningkat memperburuk stres oksidatif, yang selanjutnya merusak struktur dan fungsi seluler [ 7 , 8 ]. Stres retikulum endoplasma (ERS) memainkan peran penting dalam proses ini, karena stres metabolik yang diinduksi hiperglikemia mengganggu fungsi ER, yang menyebabkan akumulasi protein yang tidak terlipat dan ERS persisten, yang memicu respons protein yang tidak terlipat (UPR) [ 9 ]. Dalam kasus yang parah, ERS menginduksi apoptosis, memperburuk lingkungan mikro luka, dan menghambat penyembuhan [ 10 , 11 ].
Selenium, elemen jejak penting, mengatur keseimbangan redoks, pertumbuhan sel, dan diferensiasi [ 12 , 13 ]. Ia melindungi sel-β pankreas dengan mengurangi ROS, meringankan stres oksidatif, dan memodulasi ERS, sehingga mencegah kesalahan pelipatan protein dan apoptosis [ 7 ]. Biomaterial yang mengandung selenium telah dieksplorasi untuk aplikasi anti-tumor [ 14 , 15 ], anti-bakteri [ 16 ], dan anti-inflamasi [ 17 ]. Efek biologisnya bergantung pada konsentrasi, menunjukkan pola bimodal [ 18 ]. Dibandingkan dengan selenium anorganik, selenium organik menawarkan bioavailabilitas yang lebih tinggi, toksisitas yang lebih rendah, dan penerapan yang lebih luas, sehingga ideal untuk pengembangan biomaterial [ 19 ]. Sementara asam amino selenium dan selenoprotein adalah sumber selenium organik alami [ 20 ], sintesisnya rumit, mahal, dan sensitif terhadap faktor lingkungan, sehingga membatasi stabilitas [ 21 ]. Sebaliknya, polimer yang mengandung selenium memberikan stabilitas yang lebih besar, membuatnya lebih cocok untuk aplikasi biomedis.
Poliuretana (PU), polimer yang banyak digunakan, mudah disintesis dan memfasilitasi ikatan hidrogen dengan biomaterial. Penggabungan selenium ke dalam kerangka PU menghasilkan poliuretana yang mengandung selenium (SePU), yang membentuk gugus keton selenium dalam kondisi oksidatif [ 22 ]. Dibandingkan dengan nanopartikel selenium [ 23 – 25 ], SePU memiliki struktur yang ditentukan secara kimia dan keadaan valensi selenium yang stabil (−2), yang menawarkan pengendalian dan potensi translasi yang lebih baik untuk aplikasi biomedis.
Properti ini menjadikan SePU menjanjikan untuk biomaterial yang merespons stres oksidatif. Potensinya untuk mengurangi stres seluler dalam penyembuhan luka diabetes masih belum dieksplorasi, dan kontrol konsentrasi yang tepat diperlukan karena efek biologis bimodal selenium.
Hidrogel banyak digunakan dalam penyembuhan luka tetapi memiliki keterbatasan, termasuk penambahan antibiotik dan kurangnya spesifisitas untuk luka diabetes. Saat ini, belum ada obat yang disetujui secara klinis khusus untuk penyembuhan luka diabetes. Sebagian besar perawatan bergantung pada tindakan perawatan tradisional, seperti debridemen, pembalut lembap, dan pengendalian infeksi [ 26 , 27 ]. Sementara antibiotik membantu mengelola peradangan kronis dan infeksi, penggunaan jangka panjang berisiko menimbulkan resistensi obat dan efek samping, sehingga menghambat penyembuhan [ 28 , 29 ]. Alternatif seperti insulin [ 30 ] dan ion logam [ 31 , 32 ] sering menargetkan aspek tertentu, seperti aktivitas antimikroba atau pengurangan peradangan, tanpa mengatasi mekanisme penyembuhan luka yang komprehensif. Hidroksibutil kitosan (HBC), turunan kitosan, mempertahankan biodegradabilitas, sifat antimikroba, toksisitas rendah, dan non-imunogenisitas dari senyawa induknya sambil menawarkan respons suhu untuk ikatan silang in situ dalam kondisi fisiologis [ 33 ]. Sebagai pembawa hidrogel, HBC melekat erat pada luka dan mudah ditangani, sehingga ideal untuk aplikasi penyembuhan luka diabetes [ 34 ].
Oleh karena itu, penelitian ini bertujuan untuk menggabungkan keunggulan SePU dan HBC guna mengembangkan hidrogel termosensitif SePU (SePU/HBC). Hidrogel ini berikatan silang dengan cepat sebagai respons terhadap suhu tubuh, sehingga menawarkan operabilitas yang sangat baik. Selain itu, kandungan seleniumnya mendorong adhesi, proliferasi, dan migrasi fibroblas, sementara sifat antiinflamasinya yang kuat meningkatkan fungsi sel dalam lingkungan diabetes, sehingga mempercepat proses penyembuhan luka pada diabetes. Lebih jauh, penelitian ini menyelidiki mekanisme SePU/HBC, menjelaskan bagaimana ia meringankan ERS yang disebabkan oleh diabetes dan menghambat apoptosis, sehingga memberikan strategi terapi baru untuk penyembuhan luka diabetes (Gambar 1 ).
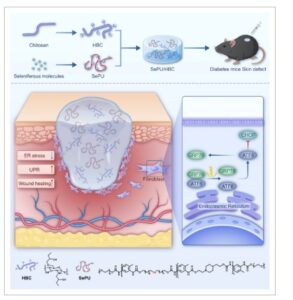
GAMBAR 1
Buka di penampil gambar
Presentasi PowerPoint
Skema penelitian ini. Hidrogel termosensitif poliuretana (SePU) yang mengandung selenium (SePU/HBC) dibuat dengan menggabungkan SePU ke dalam hidroksibutil kitosan (HBC). Hidrogel ini mengurangi stres retikulum endoplasma (ERS) dan menghambat apoptosis sel dengan mengaktifkan respons protein yang tidak terlipat (UPR), sehingga mempercepat penyembuhan luka diabetes.
2 Hasil
2.1 Persiapan dan Karakterisasi Fisikokimia SePU/HBC
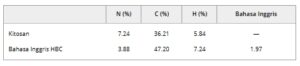
Pertama, kitosan digunakan sebagai bahan baku untuk mensintesis HBC melalui reaksi eterifikasi. HBC, yang menunjukkan sifat responsif terhadap suhu, digunakan sebagai pembawa hidrogel dalam penelitian ini. Analisis unsur kitosan dan HBC dilakukan untuk menentukan persentase massa setiap unsur dalam molekul (Tabel 1 ). Karena jumlah atom nitrogen dalam struktur molekul tetap konstan, nitrogen digunakan sebagai referensi untuk menghitung derajat substitusi (DS). DS gugus hidroksibutil dalam HBC dihitung sebesar 1,97. Selanjutnya, SePU dimasukkan ke dalam HBC melalui pencampuran, menghasilkan pembentukan SePU/HBC.
TABEL 1. Hasil analisis unsur kitosan dan HBC.
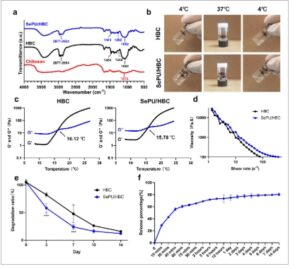
Analisis FTIR kitosan, HBC, dan SePU/HBC mengungkap perubahan signifikan. Dibandingkan dengan spektrum FTIR kitosan asli, spektrum HBC menunjukkan puncak serapan berbeda pada 1464 cm −1 dan 2877–2964 cm −1 , yang sesuai dengan vibrasi tekuk ─CH₂ dan regangan C─H dari gugus hidroksibutil (gugus fungsi spesifik dalam HBC), yang mengonfirmasi keberhasilan pencangkokan pada tulang punggung kitosan. Selain itu, puncak serapan getaran regangan C─O dari gugus C─OH dalam kitosan muncul pada 1073 cm −1 , yang bergeser ke 1062 cm −1 dalam HBC, yang menunjukkan bahwa gugus hidroksil berhasil dimasukkan pada posisi C─OH. Analisis lebih lanjut terhadap spektrum SePU/HBC menunjukkan bahwa puncak serapan karakteristik HBC pada 1244 cm −1 bergeser ke 1262 cm −1 pada SePU/HBC, yang menunjukkan perubahan dalam lingkungan kimia akibat penggabungan SePU. Pergeseran ini kemungkinan besar merupakan hasil interaksi antara HBC dan SePU, seperti ikatan hidrogen atau gaya antarmolekul (Gambar 2a ).
GAMBAR 2
Buka di penampil gambar
Presentasi PowerPoint
Karakterisasi fisikokimia HBC dan SePU/HBC. (a) Spektrum inframerah transformasi Fourier dari kitosan, HBC, dan SePU/HBC. (b) Foto HBC dan SePU/HBC pada suhu 4°C, 37°C, dan setelah pendinginan ulang hingga 4°C. (c) Modulus elastisitas (G′) dan modulus viskositas (G″) HBC dan SePU/HBC sebagai fungsi suhu. (d) Viskositas HBC dan SePU/HBC pada suhu 37°C sebagai fungsi laju geser. (e) Kurva degradasi in vitro HBC dan SePU/HBC. (f) Kurva pelepasan SePU dari SePU/HBC secara in vitro (*** p < 0,001).
HBC dan SePU/HBC menunjukkan perilaku termo-sensitif, yang ada sebagai sol yang dapat mengalir pada suhu 4°C, yang memfasilitasi penanganan dan injeksi. Pada suhu 37°C, mereka mengalami ikatan silang reversibel untuk membentuk gel padat, dengan proses yang sepenuhnya reversibel setelah didinginkan hingga 4°C (Gambar 2b ). Analisis reologi dilakukan untuk menyelidiki sifat responsif suhu dari hidrogel ini. Suhu transisi sol–gel (T i ) diidentifikasi sebagai titik di mana modulus elastisitas (G′) memotong modulus viskos (G″) selama pemanasan. Di bawah T i , hidrogel tetap dalam keadaan sol, bertransisi ke keadaan gel di atas T i . Hasil reologi menunjukkan bahwa T i HBC adalah 16,12°C, yang merupakan 15,78°C setelah penggabungan SePU, lebih rendah dari HBC, mungkin karena interaksi antara SePU dan HBC. Kedua suhu transisi berada di bawah suhu fisiologis, yang menunjukkan pembentukan gel dalam kondisi fisiologis (Gambar 2c ). Selain itu, profil viskositas hidrogel pada suhu 37°C menunjukkan perilaku pengenceran geser yang nyata, dengan viskositas menurun tajam saat laju geser meningkat. Khususnya, SePU/HBC menunjukkan kemampuan alir yang lebih unggul dibandingkan dengan HBC, yang menoleransi laju geser yang lebih tinggi pada viskositas yang setara (Gambar 2d ). Hal ini menunjukkan peningkatan kemampuan adaptasi dan stabilitas mekanis SePU/HBC di bawah gaya eksternal.
Sifat degradasi dan pelepasan SePU/HBC dievaluasi dengan menganalisis laju degradasi hidrogel dan profil pelepasan SePU. Eksperimen degradasi in vitro dilakukan dalam cairan tubuh simulasi (SBF) selama 14 hari. SePU/HBC menunjukkan laju degradasi yang jauh lebih cepat daripada HBC selama fase awal, dengan massa residu turun hingga 58% pada hari ke-3 dan 24% pada hari ke-7. Namun, seiring dengan kemajuan degradasi, laju kedua hidrogel tersebut menyatu, mencapai titik akhir degradasi yang sama pada hari ke-14 (Gambar 2e ). Pelepasan SePU dari SePU/HBC diukur dengan mengukur densitas optik (OD) pada 231 nm dan menghitung laju pelepasan menggunakan kurva standar. SePU menunjukkan pelepasan awal yang cepat, mencapai 75% dalam 2 hari pertama, diikuti oleh fase pelepasan yang lebih lambat, yang berpuncak pada sekitar 80% pelepasan kumulatif pada hari ke-14 (Gambar 2f ). Gambar SEM (Gambar S1 ) menunjukkan struktur berpori pada hidrogel HBC dan SePU/HBC, dengan ukuran pori yang sesuai untuk pertumbuhan sel.
2.2 Dampak SePU/HBC terhadap Proliferasi dan Penyebaran HSF
Proliferasi dan penyebaran sel dini sangat penting untuk penyembuhan luka yang efisien. Untuk mengevaluasi biokompatibilitas in vitro SePU/HBC dan dampaknya terhadap penyebaran sel dini, viabilitas sel, proliferasi, dan penyebaran fibroblas kulit manusia (HSF) dinilai. Konsentrasi SePU dalam SePU/HBC ditetapkan pada 0,2, 0,5, 1,0, 2,0, dan 5,0 µg/mL.
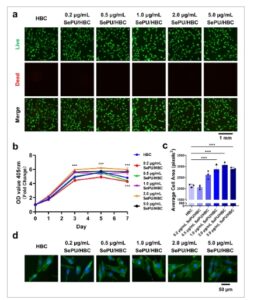
Untuk menyelidiki efek SePU/HBC dengan berbagai konsentrasi SePU pada viabilitas sel HSF, HBC digunakan sebagai kontrol. Viabilitas sel dievaluasi pada konsentrasi SePU sebesar 0,2, 0,5, 1,0, 2,0, dan 5,0 µg/mL. Setelah 2 hari kultur, sel hidup dan mati diberi label dengan Calcein-AM dan PI. Hasilnya menunjukkan bahwa sebagian besar sel yang dikultur dengan ekstrak SePU/HBC tetap viabilitas, dengan hanya beberapa sel mati, yang menunjukkan tidak ada efek buruk pada viabilitas HSF (Gambar 3a ).
GAMBAR 3
Buka di penampil gambar
Presentasi PowerPoint
Efek dari berbagai konsentrasi SePU/HBC pada proliferasi dan penyebaran HSF. (a) Pewarnaan hidup/mati HSF setelah 2 hari kultur, hijau: sel hidup, merah: sel mati. (b) Uji CCK-8 untuk menilai viabilitas sel selama proliferasi HSF. (c) Pewarnaan DAPI-phalloidin yang mengukur rata-rata area penyebaran HSF. (d) Gambaran mikroskopis pewarnaan DAPI-phalloidin, biru: nukleus, hijau: sitoskeleton (* p < 0,05, ** p < 0,01, *** p < 0,001).
Uji CCK-8 mengungkapkan bahwa pada konsentrasi SePU yang lebih tinggi (1,0, 2,0, dan 5,0 µg/mL), proliferasi sel HSF meningkat secara signifikan dibandingkan dengan HBC, yang menunjukkan efek yang mendorong proliferasi. Sebaliknya, pada konsentrasi yang lebih rendah (0,2 dan 0,5 µg/mL), efek proliferasi lebih lemah, dengan proliferasi sel yang lebih lambat pada hari ke-1, ke-3, ke-5, dan ke-7 dibandingkan dengan HBC (Gambar 3b ). Hasil ini menunjukkan bahwa SePU/HBC, pada konsentrasi yang tepat, dapat secara efektif mendorong proliferasi HSF dan viabilitas sel secara in vitro, menunjukkan biokompatibilitas yang baik dan tidak ada sitotoksisitas yang signifikan. Uji hemolisis selanjutnya menegaskan bahwa semua kelompok menunjukkan tingkat hemolisis di bawah 1%, yang menyoroti kompatibilitas darah yang sangat baik dari SePU/HBC (Gambar S2 ).
Untuk menilai efek SePU/HBC pada adhesi dan penyebaran sel awal, HSF dikultur dengan ekstrak SePU/HBC selama 2 hari dan selanjutnya diwarnai dengan DAPI dan FITC-phalloidin untuk memberi label pada inti sel dan sitoskeleton. Gambar sel dianalisis secara kuantitatif menggunakan ImageJ. Kecuali untuk SePU/HBC 0,2 µg/mL, semua kelompok eksperimen lainnya menunjukkan luas sel rata-rata yang lebih besar dibandingkan dengan HBC, dengan peningkatan paling signifikan diamati pada kelompok konsentrasi yang lebih tinggi (1,0, 2,0, dan 5,0 µg/mL SePU/HBC) (Gambar 3c ). Gambar fluoresensi menunjukkan tren yang konsisten. Dibandingkan dengan HBC, semua kelompok eksperimen, kecuali kelompok SePU/HBC 0,2 µg/mL, menunjukkan cakupan fluoresensi hijau yang jauh lebih besar pada sitoskeleton, yang menunjukkan peningkatan penyebaran sel (Gambar 3d ). Temuan ini menunjukkan bahwa SePU/HBC, pada konsentrasi yang tepat, meningkatkan penyebaran sel HSF secara awal secara in vitro.
2.3 Efek SePU/HBC pada Migrasi, Adhesi, dan Peradangan HSF secara in vitro
Penyebaran sel dini diikuti oleh migrasi untuk lebih meningkatkan penyembuhan luka. Untuk mengeksplorasi efek SePU/HBC pada migrasi dan adhesi HSF secara in vitro, uji goresan dilakukan untuk menilai migrasi horizontal. Migrasi sel dipantau pada 0, 12, dan 24 jam pasca-penggarukan dalam bidang pandang yang sama. Setelah 12 jam, SePU/HBC secara signifikan meningkatkan migrasi horizontal dibandingkan dengan HBC, dengan pengurangan yang nyata pada lebar luka. Setelah 24 jam, sel-sel dari kedua sisi goresan dalam 2,0 µg/mL SePU/HBC telah bertemu, menunjukkan laju migrasi tertinggi (Gambar 4a ). Laju migrasi pada berbagai titik waktu diukur menggunakan ImageJ, dan hasilnya menunjukkan bahwa semua konsentrasi SePU/HBC secara signifikan meningkatkan migrasi pada 12 jam. Pada 24 jam, 2,0 dan 5,0 µg/mL SePU/HBC menunjukkan migrasi terbesar (Gambar 4b,c ).
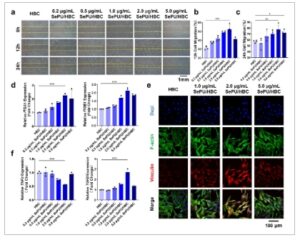
GAMBAR 4
Buka di penampil gambar
Presentasi PowerPoint
Pengaruh konsentrasi SePU/HBC yang berbeda terhadap migrasi HSF, adhesi, dan inflamasi. (a) Gambaran mikroskopis kemampuan migrasi sel HSF dengan uji gores. (b dan c) Analisis kuantitatif migrasi HSF pada 12 dan 24 jam dengan uji gores. (d) Analisis RT-qPCR ekspresi gen terkait adhesi ITGA1 dan ITGB1 . (e) Pewarnaan imunofluoresensi untuk mendeteksi ekspresi protein vinculin, protein terkait adhesi. (f) Analisis RT-qPCR ekspresi gen terkait inflamasi TNFα dan TGFβ (* p < 0,05, ** p < 0,01, *** p < 0,001).
Selain analisis migrasi, ekspresi gen terkait adhesi ITGA1 dan ITGB1 dinilai melalui RT-qPCR. Analisis kuantitatif mengungkapkan bahwa SePU pada semua konsentrasi meningkatkan ekspresi gen, dengan peningkatan regulasi paling signifikan diamati pada 2,0 µg/mL SePU/HBC (Gambar 4d ). Berdasarkan efek signifikan yang diamati dalam RT-qPCR, pewarnaan imunofluoresensi untuk protein terkait adhesi Vinculin dilakukan pada sel yang diobati dengan konsentrasi SePU/HBC yang lebih tinggi (1,0, 2,0, dan 5,0 µg/mL). Kelompok SePU/HBC 2,0 µg/mL menunjukkan intensitas fluoresensi Vinculin terkuat, yang mencerminkan perbedaan yang paling mencolok (Gambar 4e ). Untuk lebih menyempurnakan konsentrasi SePU yang optimal, kami membandingkan ekspresi Vinculin pada 1,0–5,0 µg/mL. Kelompok 2,0 µg/mL menunjukkan peningkatan regulasi tertinggi, dengan 3,0 µg/mL menghasilkan hasil yang serupa tetapi tidak lebih baik. Ekspresi menurun pada 4,0 dan 5,0 µg/mL, dengan demikian, 2,0 µg/mL dipilih sebagai dosis optimal untuk keseimbangan antara kemanjuran dan keamanannya (Gambar S3 ).
Studi ini juga mengeksplorasi efek SePU/HBC pada sekresi faktor terkait inflamasi oleh HSF secara in vitro. Hasilnya menunjukkan bahwa 1,0 dan 2,0 µg/mL SePU/HBC mengurangi ekspresi gen pro-inflamasi TNFα , sementara 1,0, 2,0, dan 5,0 µg/mL SePU/HBC meningkatkan ekspresi gen anti-inflamasi TGFβ (Gambar 4f ). Temuan ini menunjukkan bahwa SePU/HBC tidak hanya meningkatkan migrasi dan adhesi HSF tetapi juga memodulasi inflamasi dengan menekan inisiasinya. Di antara konsentrasi yang diuji, 2,0 µg/mL SePU/HBC menunjukkan efek yang paling menonjol, menjadikannya konsentrasi optimal untuk studi in vivo dan mekanistik berikutnya.
2.4 SePU/HBC Meningkatkan Penyembuhan Luka Kulit pada Tikus Penderita Diabetes
Bahasa Indonesia: Untuk mengevaluasi apakah SePU/HBC mempertahankan efek positifnya pada penyembuhan luka dalam lingkungan diabetes, kami menggunakan tikus BSK-db/db diabetes sebagai model in vivo. Cacat kulit ketebalan penuh (diameter 10 mm) dibuat di punggung tikus, dan sol–gel SePU/HBC disuntikkan langsung ke permukaan luka dalam keadaan sol dalam kondisi suhu rendah. Suhu tubuh tikus memicu transisi sol–gel dari hidrogel. Gambar makroskopis luka yang ditutupi dengan HBC, SePU/HBC, atau tanpa hidrogel (kelompok Blank) diambil pada hari ke-0, 3, 7, 10, dan 14 (Gambar 5a ). Hasil penelitian mengungkapkan bahwa HBC menunjukkan penyembuhan yang sedikit lebih baik daripada kelompok Blank dalam kondisi diabetes, sementara SePU/HBC menunjukkan penyembuhan yang jauh lebih unggul, dengan penutupan luka yang ditingkatkan di semua titik waktu (Gambar 5b ). Penyesuaian morfologi luka pada setiap titik waktu menunjukkan bahwa SePU/HBC memiliki area luka yang secara signifikan lebih kecil dibandingkan dengan HBC pada hari ke-7, dan penyembuhan hampir lengkap pada hari ke-14 (Gambar 5c ). Analisis statistik mengonfirmasi bahwa SePU/HBC secara signifikan mempercepat penyembuhan luka relatif terhadap HBC (Gambar 5d ), yang menunjukkan kemanjurannya dalam meningkatkan penyembuhan luka pada luka diabetes. Untuk menilai biokompatibilitas SePU/HBC, analisis histologis organ utama (jantung, hati, limpa, paru-paru, dan ginjal) dilakukan. Pewarnaan H&E tidak mengungkapkan peradangan signifikan pada salah satu organ utama, yang mengonfirmasi profil biokompatibilitas dan keamanan SePU/HBC yang sangat baik secara in vivo (Gambar 5e ).
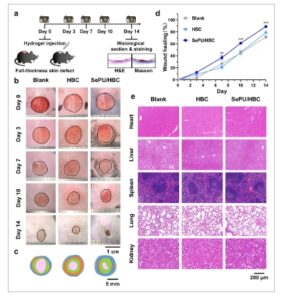
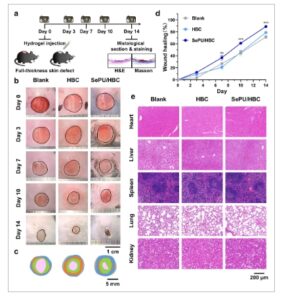
GAMBAR 5
Buka di penampil gambar
Presentasi PowerPoint
Efek SePU/HBC pada penyembuhan luka kulit ketebalan penuh pada tikus diabetes. (a) Diagram skema yang menggambarkan terciptanya cacat kulit ketebalan penuh pada tikus diabetes dan injeksi hidrogel ke dalam luka. Gambar makroskopis penyembuhan luka diambil pada hari ke-0, 3, 7, 10, dan 14, dengan jaringan kulit dikumpulkan untuk analisis histologis pada hari ke-14. (b) Gambar makroskopis luka kulit ketebalan penuh pada tikus diabetes yang diobati dengan Blank, HBC, atau SePU/HBC pada hari ke-0, 3, 7, 10, dan 14. (c) Representasi skematis perubahan morfologi luka selama 14 hari dalam kelompok yang berbeda. (d) Perbandingan kuantitatif tingkat penyembuhan luka berdasarkan perubahan luas luka antara kelompok ( n = 8). (e) Gambar makroskopis pewarnaan H&E pada jantung, hati, limpa, paru-paru, dan ginjal dari setiap kelompok (** p < 0,01, *** p < 0,001).
Untuk menilai rekonstruksi luka, analisis histologis luka kulit dan jaringan di sekitarnya dilakukan pada hari ke-14 menggunakan pewarnaan H&E dan Masson. Pewarnaan H&E mengungkapkan bahwa pada kelompok Blank, luka tetap tidak sembuh dengan jaringan granulasi yang tidak rata, epidermis tipis, dan infiltrasi neutrofil yang signifikan di dermis. Pada kelompok HBC, ketebalan epidermis lebih tebal daripada pada kelompok Blank, tetapi peradangan persisten menunjukkan bahwa HBC saja tidak cukup untuk mengendalikan peradangan secara efektif dalam penyembuhan luka diabetes. Sebaliknya, kelompok SePU/HBC menunjukkan epidermis paling tebal dan infiltrasi sel inflamasi minimal dalam jaringan granulasi, yang menunjukkan kemampuannya yang unggul untuk mengelola peradangan (Gambar 6a ).
GAMBAR 6
Buka di penampil gambar
Presentasi PowerPoint
Analisis histologis SePU/HBC pada penyembuhan luka defek kulit ketebalan penuh pada tikus diabetes. (a dan b) Gambaran optik pewarnaan H&E dan Masson pada luka kulit yang diobati dengan Blank, HBC, dan SePU/HBC pada hari ke-14, termasuk tampilan yang diperbesar (E: Epidermis; D: Dermis; H: Hipodermis). Garis putus-putus kuning menunjukkan batas antara epidermis dan dermis (panah kuning: kelenjar sebasea; panah merah muda: pembuluh darah; panah hijau: folikel rambut). (c) Analisis kuantitatif lebar epidermis berdasarkan pewarnaan histologis di seluruh kelompok. (d) Perbandingan kuantitatif ketebalan epidermis di seluruh kelompok. (e) Rasio luas serat kolagen di setiap kelompok ( n = 8) (*** p < 0,001).
Pewarnaan Masson dengan jelas menyoroti penyembuhan luka dan rekonstruksi yang ditingkatkan yang difasilitasi oleh SePU/HBC (Gambar 6b ). Pada kelompok Blank, banyak pembuluh darah mikro di dekat luka menunjukkan bahwa perbaikan jaringan granulasi masih dalam tahap awal. Serat kolagen subkutan tersusun longgar, belum matang, dan tidak memiliki tanda-tanda pematangan. Pada kelompok HBC, penyembuhan lebih maju, ditandai dengan epidermis yang lebih tebal dan remodeling vaskular yang lebih matang di dermis. Meskipun kepadatan serat kolagen secara signifikan lebih tinggi daripada kelompok Blank, seratnya agak tidak teratur. Sejumlah kecil pelengkap kulit, seperti kelenjar sebasea, juga diamati pada kelompok HBC. Sebaliknya, kelompok SePU/HBC menunjukkan rekonstruksi luka yang lebih cepat dan komprehensif. Epidermis yang terus menerus dan utuh hadir, disertai dengan peningkatan pembuluh darah subkutan, folikel rambut, kelenjar sebasea, dan pelengkap kulit lainnya. Serat kolagen dalam kelompok SePU/HBC terorganisir dengan baik dan lebih matang. Hasil ini menggarisbawahi efektivitas SePU/HBC dalam mempercepat penyembuhan luka diabetes.
Analisis kuantitatif lebar luka epidermis, ketebalan epidermis, dan serat kolagen dilakukan berdasarkan data histologis. Re-epitelialisasi, penanda penting penyembuhan luka, menunjukkan bahwa kelompok SePU/HBC mencapai lebar luka epidermis terkecil dan ketebalan epidermis tertinggi (124,3 ± 15,56 µm), yang menandakan re-epitelialisasi paling lengkap (Gambar 6c,d ). Selain itu, evaluasi statistik rasio luas serat kolagen dari pewarnaan Masson menegaskan bahwa kelompok SePU/HBC secara signifikan mengungguli kelompok lain dalam mendorong penyembuhan luka (Gambar 6e ).
Temuan ini menunjukkan bahwa SePU/HBC secara efektif meningkatkan re-epitelialisasi luka kulit diabetes, mempercepat sintesis dan pematangan serat kolagen, serta mendukung regenerasi pembuluh darah dan pelengkap kulit. Dengan demikian, SePU/HBC muncul sebagai strategi terapi yang sangat efektif untuk meningkatkan penyembuhan luka diabetes.
2.5 SePU/HBC Meredakan Stres Retikulum Endoplasma dengan Mengaktifkan Respons Protein yang Tidak Terlipat
Untuk menjelaskan mekanisme yang mendasari promosi penyembuhan luka diabetes oleh SePU/HBC, penelitian ini menggunakan HSF yang dikulturkan dengan glukosa tinggi (HG) sebagai model diabetes in vitro dan melakukan RNA-seq untuk mengidentifikasi jalur potensial yang terlibat. Analisis transkriptomik mengungkap peningkatan regulasi yang signifikan dari sensor ERS, Activating transcription factor 6 (ATF6) dalam kelompok SePU/HBC (Gambar 7a,b ). Selain itu, analisis GO dan KEGG menyoroti hubungan yang kuat antara gen yang diekspresikan secara berbeda dan regulasi respons terhadap rangsangan (Gambar 7c,d ).
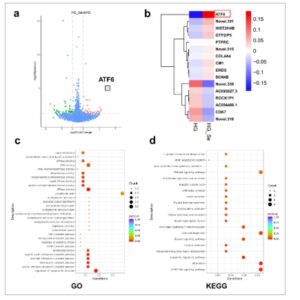
GAMBAR 7
Buka di penampil gambar
Presentasi PowerPoint
Analisis RNA-seq dari HSF untuk menyelidiki mekanisme yang digunakan SePU/HBC untuk meningkatkan penyembuhan luka diabetes. (a) Plot gunung berapi dari gen yang diekspresikan secara berbeda. (b) Peta panas dari gen yang diekspresikan secara berbeda. (c) Analisis GO. (d) Analisis KEGG.
Untuk mengevaluasi apakah SePU/HBC mempertahankan efikasinya dalam lingkungan HG in vitro, RT-qPCR digunakan untuk menilai ekspresi gen terkait adhesi dan inflamasi. Hasil penelitian menunjukkan bahwa 2,0 µg/mL SePU/HBC secara signifikan meningkatkan adhesi dan migrasi sel dalam HSF, sebagaimana dibuktikan oleh peningkatan regulasi gen terkait adhesi ITGA1 dan ITGB1 (Gambar 8a ). Lebih jauh lagi, ekspresi gen pro-inflamasi TNFα diturunkan regulasinya, sementara gen anti-inflamasi TGFβ meningkat regulasinya, yang menunjukkan bahwa 2,0 µg/mL SePU/HBC secara efektif mengurangi inflamasi dalam kondisi HG (Gambar 8b ). Dalam kondisi HG, fungsi ER yang terganggu memicu respons ERS. Untuk mengelola akumulasi protein yang salah lipat dan tidak terlipat dalam lumen ER, sel mengaktifkan UPR. ATF6 adalah sensor ERS yang terdisosiasi dari ER-resident chaperone glucose-regulated protein 78 (GRP78) di bawah tekanan, menjadi aktif untuk memulai UPR. Untuk menyelidiki mekanisme yang dengannya SePU/HBC meringankan ERS dan mendorong penyembuhan luka melalui aktivasi UPR, digunakan untuk mengevaluasi ekspresi gen kunci. Hasil penelitian menunjukkan bahwa 2,0 µg/mL SePU/HBC secara signifikan meningkatkan sensor ERS ATF6 , dengan demikian mengaktifkan UPR. Hal ini disertai dengan peningkatan yang nyata dalam ekspresi gen target UPR GRP78 , yang meningkatkan kapasitas pelipatan protein dan memulihkan fungsi ER (Gambar 8c ). Selain itu, protein homolog C/EBP (CHOP), suatu faktor transkripsi, memainkan peran sentral dalam apoptosis yang diinduksi ERS. Untuk melawan apoptosis yang dimediasi CHOP, sel-sel meningkatkan gen terkait UPR seperti ATF6 dan GRP78. Proses ini meringankan ERS, mengurangi ekspresi dan aktivitas CHOP, dan akhirnya mempertahankan homeostasis seluler. RT-qPCR menunjukkan bahwa penurunan regulasi gen CHOP yang terkait dengan apoptosis menyoroti peran menguntungkan SePU/HBC dalam mengurangi ERS (Gambar 8c ). Secara konsisten, analisis western blot dari protein pivotal ERS dan UPR mengungkapkan peningkatan ekspresi ATF6 dan GRP78, ditambah dengan penurunan ekspresi CHOP (Gambar 8d ). Temuan ini menunjukkan bahwa SePU/HBC meringankan ERS dalam kondisi diabetes dengan mengaktifkan ATF6 dan memulai UPR, sehingga menekan apoptosis dan meningkatkan penyembuhan luka diabetes.
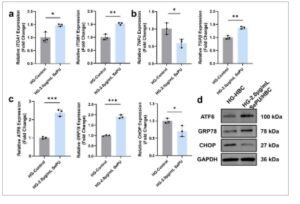
GAMBAR 8
Buka di penampil gambar
Presentasi PowerPoint
SePU/HBC meringankan ERS dan menghambat apoptosis dengan mengaktifkan UPR. (a) Analisis RT-qPCR dari gen-gen terkait adhesi ( ITGA1 , ITGB1 ) dalam kondisi glukosa tinggi. (b) Analisis RT-qPCR dari gen-gen terkait inflamasi ( TNFα , TGFβ ) dalam kondisi glukosa tinggi. (c) Analisis RT-qPCR dari gen-gen terkait ERS ( ATF6 , GRP78 , CHOP ) dalam kondisi glukosa tinggi. (d) Analisis Western blot dari protein-protein terkait ERS (ATF6, GRP78, CHOP) (* p < 0,05, ** p < 0,01, *** p < 0,001).
3 Diskusi
Studi ini berhasil mensintesis hidrogel HBC yang mengandung SePU yang peka terhadap suhu (SePU/HBC) dengan kemampuan mengatur ERS. Dengan memulihkan fungsi seluler yang terganggu oleh hiperglikemia dan menghambat apoptosis, hal ini meningkatkan penyembuhan luka diabetes. SePU/HBC menunjukkan kepekaan suhu yang sangat baik, dengan cepat membentuk gel pada suhu fisiologis untuk aplikasi yang mudah. Hal ini meningkatkan proliferasi, ekstensi, migrasi, dan adhesi HSF sambil memodulasi peradangan. Dalam model luka tikus diabetes, SePU/HBC secara signifikan mempercepat penyembuhan, meningkatkan re-epitelisasi, pematangan kolagen, dan regenerasi pembuluh darah dan pelengkap kulit. Studi mekanistik mengonfirmasi bahwa SePU/HBC mengaktifkan UPR, meringankan ERS, dan menghambat apoptosis, yang selanjutnya meningkatkan penyembuhan luka diabetes.
Temuan ini memperkenalkan strategi terapi baru, menyoroti peran penting ERS dalam penyembuhan luka diabetes, dan memperluas aplikasi biomedis dari biomaterial yang mengandung selenium.
Gel hidrosensitif termal dengan suhu gelasi rendah dikembangkan menggunakan hidroksibutil kitosan (HBC) yang sangat tersubstitusi. Dengan jaringan 3D, laju degradasi yang sesuai, dan kadar air yang tinggi, gel hidro secara efektif meniru lingkungan mikro penyembuhan luka [ 35 ]. Kemampuan alirnya yang baik memungkinkan ikatan silang in situ setelah injeksi, memastikan adhesi luka yang erat [ 36 , 37 ]. Gel hidrosensitif termal mengalami transisi sol-ke-gel pada suhu fisiologis, mencegah kerusakan jaringan akibat panas selama ikatan silang [ 38 ]. HBC, turunan kitosan, mempertahankan biodegradabilitas kitosan, sifat antimikroba, toksisitas rendah, dan non-imunogenisitas sambil menunjukkan sensitivitas suhu [ 33 ]. Alkalisasi penuh meningkatkan eterifikasi, menggabungkan gugus hidroksibutil. Pengujian reologi menunjukkan bahwa hidrogel HBC 5 wt% membentuk gel pada suhu 16,12°C, lebih rendah dari suhu yang umum dilaporkan yaitu 20–30°C, dikarenakan derajat substitusi yang tinggi (1,97) [ 33 , 39 , 40 ]. Untuk meningkatkan sifat fisikokimia, SePU dimasukkan ke dalam HBC. Selenium meningkatkan mekanika hidrogel, sebagaimana dibuktikan dengan penambahan natrium selenite, yang meningkatkan viskoelastisitas, stabilitas struktural, dan efisiensi pelepasan obat [ 41 ] . Hidrogel berbasis selenium juga menunjukkan efisiensi ikatan silang yang lebih tinggi dan ketahanan lelah yang lebih baik [ 42 ]. Mengingat bioaktivitas hidrogel PU konvensional yang terbatas [ 43-45 ], HBC dipilih sebagai kontrol untuk mengevaluasi efek terapeutik SePU dengan lebih baik . Analisis FTIR mengonfirmasi keberhasilan integrasi SePU yang dioptimalkan secara struktural—dimodifikasi dengan piperazine dan mPEG—ke dalam HBC melalui interaksi intermolekul, meningkatkan hidrofilisitas, stabilitas, dan biokompatibilitas untuk penyembuhan luka diabetes. Peningkatan sifat SePU/HBC tercermin dalam tiga aspek: (1) Penurunan lebih lanjut dalam suhu gelasi hingga 15,78°C, memungkinkan transisi sol-ke-gel yang cepat pada suhu tubuh; (2) Peningkatan kemampuan alir dan penyembuhan sendiri, memungkinkan hidrogel untuk mempertahankan stabilitas di bawah gaya eksternal; (3) Degradasi awal yang dipercepat dibandingkan dengan HBC, memfasilitasi migrasi fibroblas ke lokasi luka dan mendukung pembentukan jaringan selama periode kritis penyembuhan luka 2–10 hari [ 46 ].
SePU/HBC pada konsentrasi yang tepat memodulasi perilaku fibroblas in vitro dengan memulihkan fungsi seluler yang terganggu dan menekan peradangan. Senyawa yang mengandung selenium, seperti natrium selenite dan selenocysteine, meningkatkan sintesis kolagen, meningkatkan kualitas matriks ekstraseluler, dan meningkatkan migrasi sel; namun, dosis selenium yang optimal dalam kondisi hiperglikemik masih belum jelas [ 47 ]. Meskipun penelitian sebelumnya telah menerapkan nanofiber SePU sebagai pembawa obat untuk penyembuhan luka [ 48 ], mereka mengabaikan sifat anti-inflamasi dan antioksidan yang melekat pada Se, yang dapat dicapai dengan menyesuaikan konsentrasi selenium seperti yang kami temukan dalam penelitian ini. Patch jarum mikro berbasis nanopartikel selenium yang dikembangkan untuk penyembuhan luka diabetes terutama berfokus pada peradangan dan pembersihan biofilm tanpa mengatasi efek selenium pada fibroblas [ 49 ]. SePU/HBC secara signifikan meningkatkan adhesi sel dengan mendorong adhesi awal dan penyebaran HSF, sementara konsentrasi selenium yang sesuai lebih lanjut merangsang proliferasi dan migrasi fibroblas. Analisis gen yang terkait dengan peradangan menunjukkan bahwa SePU/HBC menekan sekresi sitokin pro-inflamasi, sehingga secara efektif mengendalikan peradangan. Kemanjurannya dalam kondisi hiperglikemik memberikan dasar teoritis untuk penerapannya dalam lingkungan diabetes, dibuktikan dengan peningkatan adhesi fibroblas, pengurangan peradangan, dan peningkatan fungsi seluler.
SePU/HBC secara efektif meningkatkan penyembuhan luka diabetes in vivo dengan mengurangi infiltrasi sel inflamasi, memfasilitasi migrasi fibroblas, meningkatkan pembentukan jaringan granulasi, dan mempercepat re-epitelialisasi. Dengan mengatur lingkungan mikro luka secara komprehensif di semua tahap penyembuhan, hal ini menunjukkan potensi yang signifikan untuk perbaikan luka diabetes. Penyembuhan luka yang tertunda pada diabetes disebabkan oleh lingkungan mikro yang kompleks yang ditandai dengan hiperglikemia, hipoksia, infeksi bakteri berulang, akumulasi ROS, disregulasi sitokin dan faktor pertumbuhan, peningkatan aktivitas protease, inflamasi persisten, dan gangguan regenerasi jaringan [ 50 ]. Hidrogel fungsional yang mengatasi tantangan ini harus mengendalikan inflamasi sambil meningkatkan regenerasi jaringan. Penelitian sebelumnya memasukkan silika diatom yang dimineralisasi-seng ke dalam HBC untuk memanfaatkan sifat antimikroba dan kemotaktik seng, mengurangi inflamasi dan mempercepat penyembuhan [ 33 ]. Demikian pula, hidrogel komposit dari badan embrioid yang dideselularisasi dan HBC meningkatkan penyembuhan luka diabetes melalui polarisasi makrofag M2 [ 39 ]. Mikroneedle imunomodulatori berbasis nanopartikel selenium juga telah dikembangkan untuk mengatur kadar ROS dan menggeser makrofag ke arah fenotipe M2, yang memfasilitasi perbaikan [ 51 ]. Akan tetapi, sebagian besar penelitian berfokus terutama pada pengendalian peradangan, dengan penelitian terbatas pada pengaturan komprehensif di semua tahap penyembuhan. In vitro, SePU/HBC meningkatkan adhesi, proliferasi, dan migrasi fibroblas, yang mempercepat cakupan seluler, ini merupakan langkah kunci untuk pembentukan jaringan granulasi. In vivo, hal ini secara signifikan mengurangi infiltrasi sel inflamasi, yang menyoroti kemampuannya yang kuat dalam mengatur peradangan yang penting untuk memulai penyembuhan. Dalam model luka tikus diabetes, SePU/HBC secara signifikan meningkatkan re-epitelisasi dan regenerasi pelengkap kulit. Analisis histologis mengonfirmasi regenerasi jaringan mikrovaskular, yang selanjutnya mendukung kemanjuran terapeutiknya.
Analisis RNA-seq mengungkapkan bahwa SePU meringankan ERS dan menghambat apoptosis dengan mengaktifkan gen UPR kunci ATF6. Stres oksidatif abnormal menyebabkan akumulasi ROS, mengganggu pelipatan protein dan memicu ERS, yang mengaktifkan UPR sebagai respons adaptif untuk membersihkan protein yang salah lipat. Namun, ERS yang berkepanjangan dapat menyebabkan apoptosis [ 52 ]. ERS melibatkan tiga jalur klasik yang dimediasi oleh enzim yang membutuhkan inositol 1 (IRE1), protein kinase R-like endoplasmic reticulum kinase (PERK), dan ATF6. Dalam kondisi normal, molekul-molekul ini terikat pada protein imunoglobulin pengikat regulator UPR (BiP, juga dikenal sebagai GRP78) pada membran ER [ 53 ]. Selama ERS, GRP78 mengikat protein yang salah lipat, terdisosiasi dari IRE1, PERK, dan ATF6, sehingga mengaktifkannya. ATF6 yang teraktivasi diproses di apparatus Golgi, dan fragmen N-terminal yang dihasilkan ditranslokasi ke nukleus, mendorong ekspresi chaperone ER seperti GRP78 untuk mengurangi ERS. Sebaliknya, CHOP, faktor pro-apoptotik, berkorelasi dengan tingkat keparahan ERS dan berkontribusi pada apoptosis [ 54 ]. ERS yang tidak terkontrol memperburuk disfungsi seluler dan apoptosis dalam penyembuhan luka diabetes, mengganggu sintesis dan degradasi protein, dan memperburuk lingkungan mikro luka [ 11 ]. Untuk fokus pada efek regulasi SePU dalam kondisi glukosa tinggi, kami menggunakan kelompok HG sebagai dasar patologis dan kelompok HG-Se untuk menilai dampak SePU/HBC. SePU/HBC mengaktifkan ATF6 pada membran ER, mendorong respons UPR yang protektif. Peningkatan regulasi ATF6 meningkatkan ekspresi GRP78, meningkatkan pembersihan protein yang salah lipat dan mengurangi ERS. Secara bersamaan, penurunan regulasi CHOP menghambat apoptosis yang diinduksi oleh ERS yang berlebihan. Dengan demikian, aktivasi UPR yang dimediasi SePU/HBC dan penghambatan apoptosis menawarkan strategi terapi yang menjanjikan untuk penyembuhan luka diabetes. Sementara nilai terapi potensial SePU/HBC dalam mengurangi ERS dan menghambat apoptosis melalui aktivasi UPR yang dimediasi ATF6 telah ditunjukkan, penelitian lebih lanjut diperlukan untuk mengeksplorasi mekanisme molekuler SePU/HBC pada ERS dan UPR, dan interaksinya dengan jalur pensinyalan seluler lainnya. Studi semacam itu akan memberikan pemahaman yang lebih komprehensif tentang mekanisme kompleks yang terlibat dalam penyembuhan luka diabetes dan mendukung pengembangan pendekatan terapi baru.
4 Kesimpulan
Dalam studi ini, SePU/HBC menunjukkan kemanjuran yang unggul dalam penyembuhan luka diabetes dengan meningkatkan regenerasi jaringan. Hidrogel menunjukkan sensitivitas termal yang sangat baik, menciptakan lingkungan lembap yang ideal untuk penyembuhan sekaligus memastikan kemudahan aplikasi dan pengoperasian. Hasil eksperimen menunjukkan bahwa SePU/HBC menunjukkan biokompatibilitas in vitro yang baik, meningkatkan proliferasi, migrasi, dan adhesi HSF sekaligus menekan peradangan, dan dalam model luka kulit tikus diabetes, ia mempercepat penyembuhan secara signifikan dengan meningkatkan re-epitelialisasi, pematangan kolagen, dan regenerasi pembuluh darah dan pelengkap kulit. Studi mekanistik mengungkapkan bahwa SePU/HBC meringankan ERS dan menghambat apoptosis dengan mengaktifkan UPR, sehingga meningkatkan penyembuhan luka diabetes. Studi ini menyajikan strategi terapi yang efisien dan aman untuk perawatan luka diabetes, dengan aplikasi klinis yang menjanjikan, sekaligus juga menawarkan wawasan baru tentang peran regulasi ERS dalam penyembuhan luka, yang menjadi dasar untuk eksplorasi lebih lanjut.
5 Bagian Eksperimen
Persiapan HBC : HBC disintesis mengikuti metode yang dilaporkan sebelumnya [ 55 ]. Tambahkan 1 g kitosan (Sigma-Aldrich, AS) dalam 20 mL larutan NaOH 50 wt% dan aduk pada suhu kamar selama 48 jam untuk mencapai deasetilasi. Kemudian, 20 mL isopropanol 50% (v/v) ditambahkan, dan campuran diaduk selama 24 jam. Selanjutnya, 20 mL 1,2-butilen oksida (Aladdin, Cina) ditambahkan, dan reaksi dilakukan pada suhu 55°C selama 72 jam. pH disesuaikan menjadi 7,0 menggunakan pH meter SevenCompact S220-Basic (Mettler Toledo, Swiss). Produk didialisis dalam air suling hingga bening dan dikeringkan beku dalam vakum untuk menghasilkan HBC seperti spons.
Persiapan SePU/HBC : Sterilkan 50 mg HBC beku-kering dan larutkan dalam 1 mL PBS steril (Gibco, AS) di bawah penangas es sambil diaduk untuk memperoleh larutan hidrogel HBC 5 wt% sebagai kontrol. SePU disintesis menurut metode yang telah dilaporkan sebelumnya [ 56 ]. SePU kemudian ditambahkan ke dalam larutan untuk menyiapkan SePU/HBC dengan berbagai konsentrasi SePU. Konsentrasi SePU dalam larutan hidrogel HBC adalah 0,2, 0,5, 1,0, 2,0, dan 5,0 µg/mL. Campuran diaduk dalam penangas es hingga merata dan disimpan pada suhu 4°C untuk penggunaan selanjutnya dalam percobaan.
Analisis Unsur : Komposisi unsur kitosan dan HBC ditentukan menggunakan penganalisis unsur Vario EL-III (Elementar, Jerman). Dengan mengukur persentase nitrogen (N[%]), karbon (C[%]), dan hidrogen (H[%]) dalam sampel, dan menggunakan rumus molekul kitosan dan HBC, derajat substitusi (Ds) gugus hidroksibutil pada rantai molekul kitosan dihitung.
Spektroskopi Inframerah Transformasi Fourier (FTIR) : Spektrum inframerah kitosan, HBC, dan SePU/HBC direkam menggunakan spektrometer inframerah seri 5700 (Nicolet, AS) dengan metode pelet KBr. Parameter berikut digunakan: resolusi 4 cm −1 , rentang panjang gelombang 4000–400 cm −1 , dan laju pemindaian 32 pemindaian per detik.
Analisis Reologi : Sifat reologi HBC dan SePU/HBC dianalisis menggunakan rheometer Kenexus Pro+ (NETZSCH, Jerman) dengan pelat Peltier dan geometri pelat paralel (diameter: 20 mm, celah: 0,1 mm). Pengukuran dilakukan pada regangan 1% dan frekuensi 1 Hz pada rentang suhu 0–40°C, dengan laju pemanasan 3°C/menit. Modulus elastisitas (G′) dan modulus viskositas (G″) dicatat, dan suhu gelasi awal ( T i ) didefinisikan sebagai suhu saat G′ dan G″ sama. Viskositas yang bergantung pada geser diukur pada suhu 37°C, dengan laju geser dari 0,1 hingga 1000 s −1 .
Degradasi In Vitro : Suntikkan 100 µL HBC dan 2,0 µg/mL hidrogel SePU/HBC ke dalam tabung EP 2,5 mL pada suhu rendah. Setelah ikatan silang penuh, 1,5 mL cairan tubuh tiruan (SBF, Coolaber, Cina) ditambahkan. Sampel diinkubasi pada pengocok suhu konstan pada suhu 37°C untuk mensimulasikan degradasi. Pada hari ke-0, 3, 7, 10, dan 14, sampel dikeringkan beku, ditimbang, dan laju degradasi dihitung.
Pelepasan SePU secara In Vitro : Suntikkan 100 µL HBC dan 2,0 µg/mL hidrogel SePU/HBC ke dalam tabung EP 2,5 mL pada suhu rendah. Setelah ikatan silang penuh, 1,5 mL SBF (Coolaber, Tiongkok) ditambahkan, dan sampel ditempatkan pada pengocok suhu konstan pada suhu 37°C. Pada titik waktu yang berbeda, supernatan dikumpulkan, dan volume SBF yang sama diisi ulang. SBF digunakan sebagai kontrol kosong untuk kalibrasi. Kepadatan optik (OD) supernatan pada 231 nm diukur menggunakan spektrofotometer UV-Vis Nanodrop 8000 (Thermo Fisher Scientific, AS), dan laju pelepasan dihitung berdasarkan kurva standar.
Kultur Sel : Fibroblas kulit manusia (HSF, Cellverse, Cina) dikultur dalam medium DMEM (Gibco, AS) yang mengandung 10% serum sapi janin (FBS, ExcellBio, Cina) dan 1% penisilin-streptomisin (Gibco, AS) sebagai medium proliferasi. Untuk medium glukosa tinggi, larutan D-glukosa tambahan (Solarbio, Cina) ditambahkan ke medium proliferasi, mencapai konsentrasi glukosa akhir 50 mM. Sel dikultur pada suhu 37°C dalam inkubator CO₂ 5% (Thermo Fisher Scientific, AS) dan disubkultur ketika mencapai konfluensi 100%. Untuk percobaan in vitro, kultur sel dilakukan dengan menggunakan ekstrak hidrogel. Rasio hidrogel terhadap proliferasi atau medium glukosa tinggi adalah 1:10 untuk ekstraksi. Setelah 24 jam inkubasi, ekstrak dikumpulkan dan digunakan untuk percobaan berikutnya.
Penilaian Sitotoksisitas SePU/HBC : Sitotoksisitas SePU/HBC dievaluasi menggunakan pewarnaan sel hidup/mati dan uji Cell Counting Kit-8 (CCK-8). HSF dikultur dengan ekstrak hidrogel dari setiap kelompok selama 2 hari, diikuti dengan pewarnaan dengan larutan kerja propidium iodida (PI)/kalsein-AM yang disiapkan menggunakan kit pewarnaan sel hidup/mati (KeyGEN BioTECH, Tiongkok). Sel hidup diwarnai hijau, dan sel mati diwarnai merah. Gambar fluoresensi diambil menggunakan mikroskop fluoresensi terbalik TE2000-U (Nikon, Jepang) yang dilengkapi dengan perangkat lunak pencitraan digital NIS-Elements F3.0 [ 57 ]. HSF disemai secara seragam dengan kepadatan 1000 sel per sumur dalam pelat 96 sumur dan dikultur dengan ekstrak hidrogel dari setiap kelompok selama 7 hari. Pada hari ke 0, 1, 3, 5, dan 7, larutan kerja CCK-8 (Novbio, Cina) ditambahkan ke setiap sumur dan diinkubasi pada suhu 37°C dalam gelap selama 1 jam. OD pada 450 nm diukur menggunakan pembaca mikroplat (Genecompany, Cina) untuk mengevaluasi proliferasi sel [ 58 ].
Uji Hemolisis : Darah utuh diambil dari tikus dan disentrifugasi untuk memperoleh sel darah merah (RBC), yang dicuci tiga kali dengan garam. Ekstrak HBC dan SePU/HBC (1 mL) dicampur dengan 20 µL suspensi RBC dan diinkubasi pada suhu 37°C selama 4 jam. Setelah disentrifugasi, supernatan difoto, dan nilai OD pada 570 nm diukur untuk menilai hemolisis. H₂O dan garam berfungsi sebagai kontrol positif dan negatif.
Pewarnaan Sitoskeleton : HSF dikultur dengan ekstrak hidrogel dari masing-masing kelompok selama 2 hari. Setelah fiksasi dan permeabilisasi, sel diwarnai dengan DAPI (ZSGB-BIO, Cina) untuk nukleus dan faloidin (Abcam, Inggris) untuk sitoskeleton. Morfologi penyebaran sel diamati menggunakan mikroskop fluoresensi terbalik TE2000-U (Nikon, Jepang) yang dilengkapi dengan perangkat lunak pencitraan digital NIS-Elements F3.0. Gambar fluoresensi diambil, dan luas sel rata-rata dianalisis menggunakan perangkat lunak ImageJ.
Uji Goresan Sel : Uji goresan sel dilakukan untuk mengevaluasi efek SePU/HBC pada kemampuan migrasi horizontal HSF. HSF dikultur dengan ekstrak hidrogel dari setiap kelompok hingga mencapai 90% konfluensi, pada titik tersebut goresan dibuat. Media proliferasi diganti dengan media bebas serum, dan gambar area goresan diambil pada 0, 12, dan 24 jam menggunakan mikroskop optik (Nikon, Jepang). Area goresan dianalisis menggunakan perangkat lunak ImageJ untuk menilai laju migrasi horizontal sel.
Reaksi Rantai Polimerase Real-Time Kuantitatif (qRT-PCR) : Efek SePU/HBC pada ekspresi gen dalam HSF dievaluasi menggunakan qRT-PCR. Total RNA diekstraksi menggunakan metode Trizol (Thermo Fisher Scientific, AS) dan ditranskripsi balik menjadi cDNA setelah mengukur konsentrasi RNA. qRT-PCR dilakukan menggunakan SybrGreen (Novbio, Tiongkok) dan Sistem PCR Real-Time QuantStudio 3 (Thermo Fisher Scientific, AS). GAPDH berfungsi sebagai gen referensi internal, dan data dianalisis menggunakan metode ΔΔCt [ 59 ]. Urutan primer yang digunakan dalam penelitian ini tercantum dalam Tabel 2 .
TABEL 2. Primer reaksi berantai polimerase waktu nyata kuantitatif.

Pewarnaan Imunofluoresensi : Pewarnaan imunofluoresensi digunakan untuk menilai efek SePU/HBC pada ekspresi protein adhesi fokal vinculin dalam HSF. HSF dikultur pada slide sel dengan ekstrak hidrogel selama 3 hari, dan ekspresi vinculin dideteksi menggunakan antibodi anti-vinculin (Abclonal, 1:200). Setelah fiksasi dan permeabilisasi, slide diblokir dengan bovine serum albumin (BSA) dan diinkubasi dengan antibodi primer semalaman pada suhu 4°C. Setelah dicuci, antibodi sekunder (Proteintech, AS) ditambahkan, dan sel diwarnai dengan DAPI dan phalloidin. Gambar fluoresensi diambil menggunakan mikroskop confocal terbalik Olympus FV3000 (Olympus, Jepang) [ 60 ].
Bedah Hewan In Vivo : Tikus BKS-db/db (jantan) berusia 6–8 minggu (Cyagen, Tiongkok) digunakan untuk penelitian ini. Semua prosedur eksperimen disetujui oleh Komite Etik Pusat Ilmu Kesehatan Universitas Peking (LA2024172). Setelah anestesi intraperitoneal, tikus dicukur dan didisinfeksi. Cacat kulit setebal penuh dengan diameter 10 mm dibuat di bagian tengah punggung setiap tikus. Hidrogel disuntikkan ke lokasi luka dan dibiarkan menjadi gel, diikuti dengan menutup luka dengan pembalut steril untuk mencegah garukan. Perawatan hidrogel diberikan pada Hari ke-0, 3, 7, dan 10, bertepatan dengan fotografi dan observasi luka. Foto luka diambil pada hari ke-0, 3, 7, 10, dan 14. Area luka dianalisis menggunakan Image J, dan laju penyembuhan pada setiap titik waktu dihitung.
Analisis Histologis : Pada hari ke-14, jaringan kulit setebal penuh (diameter 1,5 cm) yang mengelilingi luka dan organ dalam (jantung, hati, limpa, paru-paru, dan ginjal) dipanen dan difiksasi dalam paraformaldehida 4%. Sampel kulit dikeringkan, ditanamkan dalam parafin, dan dipotong untuk pewarnaan histologis dengan hematoksilin dan eosin (H&E) dan trikrom Masson. Gambar diambil di bawah mikroskop optik, dan Gambar J digunakan untuk menganalisis lebar epidermis, ketebalan, dan kepadatan serat kolagen. Organ dalam dari setiap kelompok ditanamkan, dipotong, dan diwarnai dengan H&E. Pemeriksaan mikroskopis dilakukan untuk menilai tanda-tanda peradangan, dan gambar diambil.
Pengurutan RNA : Pengurutan RNA dilakukan untuk menyelidiki mekanisme kerja SePU/HBC. Total RNA yang diekstraksi dari sel menjalani penilaian kualitas sebelum pengayaan mRNA, transkripsi balik, dan amplifikasi PCR untuk membangun pustaka pengurutan. Setelah pengurutan, hasilnya dianalisis lebih lanjut menggunakan pendekatan bioinformatika, termasuk pengelompokan gen diferensial, analisis Gene Ontology (GO), dan analisis jalur Kyoto Encyclopedia of Genes and Genomes (KEGG).
Western Blotting : Sel dilisiskan menggunakan buffer lisis RIPA (Huaxingbio, Cina) yang mengandung 1% inhibitor protease dan fosfatase (NCM, Cina). Setelah sentrifugasi, total protein dikumpulkan dan diukur menggunakan metode BCA. Protein dipisahkan dengan 10% SDS-PAGE dan dipindahkan ke membran PVDF. Membran diinkubasi dengan antibodi primer semalaman pada suhu 4°C, diikuti dengan inkubasi dengan antibodi sekunder pada suhu kamar selama 1 jam. Kit deteksi chemiluminescence (ECL) yang disempurnakan (NCM, Cina) digunakan untuk memvisualisasikan pita protein [ 61 ]. Antibodi meliputi ATF6, GRP78, dan CHOP, dengan GAPDH sebagai kontrol internal, semuanya dibeli dari ZEN-BIOSCIENCE.
Analisis Statistik : Analisis statistik dilakukan menggunakan SPSS 26.0, dengan hasil dinyatakan sebagai rata-rata ± simpangan baku. Uji-t digunakan untuk membandingkan perbedaan antara dua kelompok, sementara analisis varians satu arah (ANOVA) diterapkan untuk menilai perbedaan di antara beberapa kelompok. Hasil dianggap signifikan secara statistik jika p < 0,05.
