ABSTRAK
Bahan fluoresensi nonkonvensional, yang bersifat nonaromatik atau terdiri dari sistem aromatik terisolasi, telah menarik perhatian luas karena sifat emisi yang diinduksi agregasi. Mekanisme fluoresensi nonkonvensional masih belum sepenuhnya dipahami, sehingga menghambat prediksi dan modulasi warna emisinya. Mencapai penyetelan warna penuh dalam sistem tersebut, khususnya dalam elastomer, sangat menantang. Di sini, polisiloksan berikatan silang fluoresensi disintesis menggunakan polisiloksan alifatik berujung amino dan glutaraldehida, yang menunjukkan emisi warna penuh yang dapat disetel terus-menerus melalui perlakuan termal dalam satu sistem material. Perlakuan termal polisiloksan berikatan silang memungkinkan kontrol yang tepat atas evolusi struktural fluorofor dari imina menjadi turunan 3-(2-piperidil)piridinium dan keadaan agregasinya. Ini memungkinkan modulasi warna emisi yang berkelanjutan dan luas. Selain itu, transfer muatan intramolekuler dan intermolekuler dari fluorofor nonkonvensional baru, turunan 3-(2-piperidyl)pyridinium, telah diidentifikasi, yang sangat penting untuk fluoresensi batokromik yang diinduksi agregasi. Disiapkan dari semua bahan kimia komersial, polisiloksan yang berikatan silang ini menunjukkan potensi besar untuk produksi dan aplikasi skala besar, terutama sebagai lapisan konversi cahaya fluoresensi yang fleksibel dan bahan pintar yang responsif terhadap pelarut. Lebih jauh, penelitian kami diharapkan dapat menginspirasi inovasi fluorofor nonkonvensional dalam berbagai dimensi.
1 Pendahuluan
Molekul fluoresensi organik memiliki beberapa keunggulan dibandingkan titik kuantum, logam transisi, dan bahan fluoresensi lainnya, termasuk desain struktur yang fleksibel, emisi fluoresensi yang dapat disetel, dan hasil kuantum yang lebih tinggi [ 1 ]. Namun, karena interaksi π–π yang kuat antara struktur terkonjugasi, luminesensi fluorofor organik konvensional berkurang secara signifikan atau sepenuhnya padam dalam keadaan agregasi, sehingga membatasi aplikasinya dalam fluoresensi keadaan padat [ 2 , 3 ]. Fluoresensi nonkonvensional, yang hanya mengandung heteroatom kaya elektron dengan elektron pasangan tunggal (misalnya, N, O, dan S) atau ikatan tak jenuh yang terisolasi (misalnya, C═O, C═C, dan C═N), yang nonaromatik atau terdiri dari sistem aromatik yang terisolasi, telah menarik perhatian yang signifikan karena sifat emisi yang diinduksi agregasinya [ 4 – 6 ]. Luminesensi khas tidak dapat dikaitkan dengan fluoresensi dari keadaan tereksitasi secara lokal, karena tidak ada struktur aromatik terkonjugasi yang luas yang ada [ 7 ]. Karena komposisi kimianya yang sederhana, fluoresensi nonkonvensional menawarkan keuntungan berupa bahan baku yang mudah didapat dan sintesis yang mudah, sehingga sangat menarik untuk produksi dan aplikasi skala besar [ 5 ].
Fluoresensi yang dapat disetel penuh warna sangat penting untuk memajukan pengembangan fluoresensi nonkonvensional dalam perangkat optik multiwarna [ 8 – 10 ], pencitraan multisaluran biologis [ 11 ], dan aplikasi lainnya [ 12 ]. Namun, sebagian besar fluoresensi nonkonvensional memancarkan pada kisaran 400–500 nm, dan mencapai fluoresensi nonkonvensional yang dapat disetel penuh warna masih menjadi tantangan yang signifikan [ 12 , 13 ]. Teori konjugasi melalui ruang secara bertahap telah dianggap sebagai mekanisme fenomena fluoresensi ini [ 4 , 7 , 14 – 18 ]. Ini menunjukkan bahwa, tidak seperti delokalisasi elektron intramolekul dari fluoresensi konvensional, fluoresensi nonkonvensional muncul dari delokalisasi elektron intermolekul melalui ruang yang dibentuk oleh gugusan kelompok heteroatom kaya elektron [ 7 ]. Modulasi derajat delokalisasi elektron dalam keadaan agregasi diusulkan untuk menyesuaikan panjang gelombang emisi. Penelitian perintis telah mengatur emisi fluoresensi nonkonvensional dengan meningkatkan interaksi intermolekul dan delokalisasi elektron, yang diimplementasikan melalui pengenalan ikatan hidrogen spesifik [ 19 ], kompleks transfer muatan [ 16 , 20 ], dan manipulasi konformasi rantai polimer [ 21 ]. Perlakuan termal telah muncul sebagai pendekatan yang efisien untuk menyetel emisi dengan mengubah delokalisasi elektron terlokalisasi atau menginduksi transisi keadaan agregat [ 22 , 23 ]. Hu et al. menunjukkan regulasi fluoresensi bergantung pH dalam sistem poli(maleat anhidrida-vinil asetat) (PMV) melalui pemrosesan termal, yang mengungkapkan bahwa pergeseran batokromik berasal dari gugus terkonjugasi π yang diperluas yang terbentuk dalam tulang punggung polimer [ 22 ]. Lebih jauh lagi, pemrosesan termal langsung di atas suhu transisi gelas (Tg) dari PMV juga menyebabkan perubahan emisi [ 23 ]. Namun, titik karbon/silikon yang tidak terduga yang terbentuk oleh karbonisasi selama pemrosesan termal menimbulkan tantangan dalam menjelaskan mekanisme fluoresensi [ 24 ]. Oleh karena itu, polimer yang terdefinisi dengan baik dengan fluoresensi yang diatur panas tetap sangat diinginkan untuk penyelidikan dan aplikasi mekanistik.
Elastomer fluoresensi menunjukkan potensi signifikan dalam kemasan elektronik fleksibel, material cerdas dan responsif, serta material biomedis [ 25 , 26 ]. Meskipun demikian, material fluoresensi nonkonvensional yang dapat diatur warna penuh saat ini masih terbatas pada bentuk bubuk [ 16 , 18 ]. Polisiloksan telah menarik perhatian signifikan karena elastisitas dan stabilitas termalnya yang melekat [ 25 , 27-29 ] . Fluoresensi nonkonvensional telah diamati dalam polisiloksan bercabang yang difungsionalisasi dengan gugus kaya elektron (misalnya, amino, vinil) [ 26 ]. Atom silikon dan kerangka polisiloksan dapat berpartisipasi dalam delokalisasi elektron [ 30 , 31 ] dan menyesuaikan keadaan agregasi melalui motif strukturalnya yang serbaguna [ 32 , 33 ]. Titik silikon emisi yang dapat diatur yang dibuat melalui pemrosesan termal polisiloksan yang difungsionalisasi ini dengan pengikat silang juga telah dilaporkan [ 34-36 ] . Namun, elastomer polisiloksan nonkonvensional yang dapat diatur warnanya masih belum banyak dieksplorasi. Yang menarik, sistem amina-aldehida menunjukkan pergeseran fluoresensi yang bergantung pada konsentrasi dan penyerapan rentang tampak yang intens, meskipun mekanisme yang mendasarinya masih belum sepenuhnya dijelaskan [ 37 – 39 ]. Polisiloksan yang difungsikan-amino yang diikat silang dengan senyawa aldehida dapat memungkinkan pengembangan elastomer baru dengan sifat emisi yang dapat diatur, yang selanjutnya mendorong penyelidikan dan aplikasi mekanistik.
Di sini, fluoresensi polisiloksan berikatan silang yang dapat disetel dengan warna penuh nonkonvensional telah dicapai untuk pertama kalinya dengan metode satu pot polisiloksan berujung amino dan glutaraldehida. Warna emisi polisiloksan berikatan silang dapat terus disesuaikan dari biru ke merah dengan perlakuan termal yang terkontrol. Terungkap bahwa fluoresensi batokromik terutama disebabkan oleh fluorofor nonkonvensional baru, turunan 3-(2-piperidil) piridinium. Kondisi perlakuan termal dapat sangat memengaruhi transformasi dan kepadatan titik ikatan silang, yang mengendalikan pembentukan dan agregasi fluorofor, sehingga memungkinkan penyetelan fluoresensi penuh warna. Polisiloksan berikatan silang yang berasal dari polimer komersial menunjukkan prospek yang bagus dalam aplikasi lapisan pengubah cahaya yang fleksibel dan dapat diregangkan, sensor fluoresensi yang cerdas dan responsif, dan sebagainya. Yang lebih penting, penelitian kami memberikan lebih banyak kemungkinan untuk inovasi dalam fluorofor nonkonvensional.
2 Hasil dan Pembahasan
2.1 Emisi Polisiloksan Silang yang Dapat Disesuaikan dan Berwarna Penuh
Biasanya, polisiloksan ikatan silang kimia yang dapat diatur warnanya disiapkan sebagai berikut. Awalnya, polidimetilsiloksan (APDMS) berujung 3-(aminopropil) telekelik digabungkan dengan glutaraldehida dalam tetrahidrofuran (THF) dalam kondisi suhu sekitar. Selanjutnya, larutan yang dihasilkan dipindahkan dan dituang ke dalam cetakan Teflon. Polisiloksan ikatan silang dibentuk melalui proses penguapan pelarut dan perlakuan suhu tertentu, seperti yang diilustrasikan dalam Gambar 1. Polisiloksan ikatan silang diberi label berdasarkan kondisi reaksi. Misalnya, APDMS dengan berat molekul rata-rata jumlah (M n ) sekitar 3000 diikat silang dengan glutaraldehida pada rasio molar amino/aldehid 1:2 dan kemudian diperlakukan secara termal pada 120°C selama 5 menit. Sampel khusus ini diberi nama APDMS3000 1 –Glu 2 -120°C-5 menit. Struktur ikatan silang terutama mengandung imina yang dibentuk oleh glutaraldehida dan amina [ 40 ], dengan jejak heterosiklus aromatik yang mengandung nitrogen [ 41 – 43 ]. Jalur reaksi yang sesuai dan kemungkinan struktur titik ikatan silang dirinci dalam Gambar S1 dan S2 . Struktur ikatan silang yang representatif ditunjukkan pada panel kanan atas Gambar 1 .
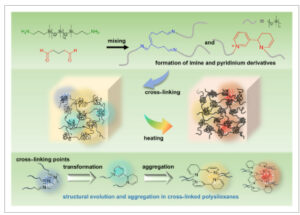 GAMBAR 1
GAMBAR 1
Buka di penampil gambar
Kekuatan Gambar
Skema sintesis polisiloksan fluoresen yang dapat diatur warnanya. Struktur ikatan silang yang representatif ditunjukkan pada panel kanan atas. Evolusi dan agregasi struktural diilustrasikan pada panel bawah.
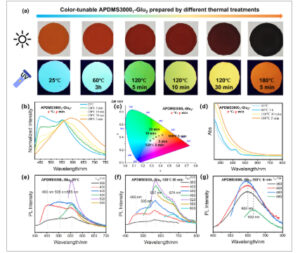
Sifat fotofisika APDMS3000 1 –Glu 2 secara sistematis dikarakterisasi dengan fotoluminesensi (PL) dan spektrum UV-vis. Pertama, perubahan fluoresensi APDMS3000 1 –Glu 2 di bawah perlakuan termal yang berbeda diselidiki, seperti yang ditunjukkan pada Gambar 2a . APDMS3000 1 –Glu 2 -25 °C menampilkan fluoresensi biru saat tereksitasi pada 365 nm. Setelah perlakuan termal pada 120 °C, fluoresensi bergeser dari biru-hijau menjadi kuning dan selanjutnya berubah menjadi merah setelah dipanaskan pada 180 °C selama 5 menit. Spektrum emisi dan diagram kromatisitas CIE dari APDMS3000 1 –Glu 2 di bawah perlakuan termal yang berbeda disajikan pada Gambar 2b,c . Perubahan warna yang sesuai konsisten dengan foto yang diambil di bawah cahaya UV 365 nm. Kemudian, perubahan yang sesuai dalam penyerapan APDMS3000 1 –Glu 2 di bawah perlakuan termal yang berbeda diselidiki. Dibandingkan dengan APDMS3000 1 –Glu 2 -25 °C, warna APDMS3000 1 –Glu 2 secara progresif mengintensifkan setelah dipanaskan hingga 120 °C, yang berpuncak pada rona hitam pekat dalam waktu 60 menit. Hal ini didukung oleh spektrum penyerapan UV–vis, yang menunjukkan bahwa penyerapan meluas hingga 600 nm (Gambar 2d ). Spektrum penyerapan menunjukkan profil yang luas dan tanpa fitur dengan ekstensi ke wilayah panjang gelombang yang lebih panjang, menyerupai pola penyerapan fluoresensi nonkonvensional yang dimediasi transfer muatan melalui ruang [ 17 , 44 ]. Perubahan spektrum sesuai dengan evolusi lebih lanjut dari struktur molekuler ikatan silang, serta pembentukan kompleks transfer muatan. Perilaku fluoresensi sistem kontrol, khususnya, APDMS murni (Mn 3000) dan larutan glutaraldehida berair 50 wt% dalam kondisi perlakuan termal yang berbeda, dikarakterisasi, seperti yang ditunjukkan pada Gambar S3 . APDMS (Mn ∼3000) menunjukkan fluoresensi intrinsik yang dapat diabaikan dan stabilitas termal yang sangat baik. Larutan glutaraldehida berair 50 wt% menunjukkan emisi fluoresensi mendekati 500 nm saat tereksitasi pada 400 nm. Namun, perlakuan termal dalam berbagai kondisi hanya memodulasi intensitas fluoresensi. Tidak ada fluoresensi batokromik yang diamati. Eksperimen kontrol selanjutnya mengonfirmasi bahwa emisi berasal dari pembentukan aduk amina–glutaralldehida daripada pengotor.
 GAMBAR 2
GAMBAR 2
Buka di penampil gambar
Kekuatan Gambar
(a) Foto sampel APDMS3000 1 –Glu 2 (solid-state) yang disiapkan dengan perlakuan termal yang berbeda di bawah sinar matahari dan sinar UV 365 nm, masing-masing. (b) Spektrum emisi yang dinormalisasi yang dieksitasi pada 400 nm, (c) diagram kromatisitas CIE, dan (d) spektrum serapan UV-vis sampel APDMS3000 1 –Glu 2 (solid-state) di bawah perlakuan termal yang berbeda. Spektrum emisi (e) APDMS3000 1 –Glu 2 -25 °C, (f) APDMS3000 1 –Glu 2 -120 °C-30 menit, dan (g) APDMS3000 1 –Glu 2 -180 °C-5 menit (solid-state) pada panjang gelombang eksitasi yang berbeda.
Ketergantungan panjang gelombang eksitasi APDMS3000 1 –Glu 2 yang disiapkan di bawah perlakuan termal yang berbeda diselidiki. Seperti yang ditunjukkan pada Gambar 2e–g , APDMS3000 1 –Glu 2 terdiri dari setidaknya empat fluorofor yang berbeda, sebagaimana dibuktikan oleh puncak emisi karakteristik pada 460, 505, 560, dan 670 nm. Profil emisi multi-puncak ini menunjukkan fitur khas fluoresensi nonkonvensional [ 4 ]. Analisis waktu hidup fluoresensi mengungkapkan bahwa waktu hidup yang signifikan diamati antara emisi 460 dan 560 nm saat tereksitasi pada 405 nm, sementara sampel yang berbeda menunjukkan waktu hidup yang sama pada panjang gelombang emisi yang identik (Gambar S4 dan Tabel S1 ). Hasil kuantum fluoresensi APDMS3000 1 –Glu 2 di bawah perlakuan termal yang berbeda, diukur pada panjang gelombang eksitasi 400, 480, 520, dan 560 nm, disajikan dalam Tabel S2 . Variasi hasil kuantum yang bergantung pada panjang gelombang diamati dalam APDMS3000 1 –Glu 2 , dikaitkan dengan sifat fotofisika yang berbeda dari fluorofor yang tereksitasi pada λ ex yang berbeda . Penurunan progresif hasil kuantum dengan peningkatan λ ex (dari 480 hingga 560 nm) ditemukan, yang menunjukkan bahwa pusat emisif yang bergeser ke merah umumnya menunjukkan hasil kuantum yang lebih rendah. Dibandingkan dengan APDMS3000 1 –Glu 2 di bawah perlakuan termal yang berbeda, hasil kuantum menurun dengan fluoresensi batokromik sampel, yang berarti proporsi fluorofor yang bergeser ke merah dengan hasil kuantum yang lebih rendah meningkat dalam sampel yang dipanaskan. Hebatnya, APDMS3000 1 –Glu 2 -25°C menunjukkan hasil kuantum sebesar 26,71% yang diukur pada λ ex = 480 nm, yang termasuk di antara nilai tertinggi yang dilaporkan untuk sistem fluoresensi nonkonvensional [ 16 , 18 , 45 ]. Temuan ini memberikan bukti substansial bahwa fluoresensi yang dapat disetel yang diamati merupakan hasil dari modifikasi struktural dalam konfigurasi molekuler atau transformasi dalam keadaan agregasi spesifik dalam sistem.
Berdasarkan karakterisasi sifat fotofisika APDMS3000 1 –Glu 2 , perilaku fluoresensi bergantung waktu dalam berbagai kondisi suhu diselidiki lebih lanjut (Gambar S5 ). Fluoresensi APDMS3000 1 –Glu 2 menunjukkan stabilitas yang hebat pada 60°C dan 90°C tetapi menunjukkan perubahan signifikan pada 120°C. (Gambar S5a ). Spektrum emisi sampel APDMS3000 1 –Glu 2 -120°C yang tereksitasi pada 400 nm diukur (Gambar S5b ), dan hubungan antara rasio intensitas fluoresensi pada 460 dan 560 nm (I 460 /I 560 ) dan waktu perlakuan termal dianalisis. I 460 /I 560 menunjukkan peluruhan eksponensial seiring waktu pemanasan (Gambar S5c ), yang menunjukkan transformasi dari fluorofor 460 menjadi 560 nm saat dipanaskan pada suhu 120°C. Transformasi yang diamati dapat berasal dari pembentukan ikatan kovalen atau jalur agregasi molekuler tertentu di bawah aktivasi termal. Karakterisasi struktural yang terperinci diperlukan untuk mengkorelasikan perubahan fluoresensi dengan transformasi yang disebabkan oleh termal.
2.2 Analisis Struktur Molekul
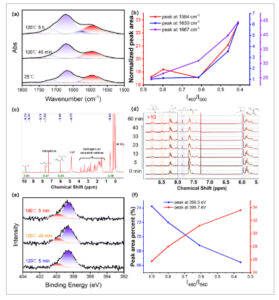
Reaksi glutaraldehida–amina menghasilkan imina yang terutama terisolasi, bersama dengan imina yang terkonjugasi sebagian dan turunan 3-(2-piperidil)piridinium [ 41 ]. Meskipun agregat imina diketahui menunjukkan fluoresensi biru nonkonvensional [ 27 , 46 ], asal molekuler dari fluoresensi penuh warna yang dapat disetel yang diinduksi secara termal masih harus dijelaskan dengan cermat. Evolusi struktural APDMS3000 1 –Glu 2 di bawah perlakuan termal yang berbeda awalnya dikarakterisasi dengan FTIR (Gambar 3a dan Gambar S6a ). Analisis spektral mengungkapkan perubahan signifikan di wilayah 1800–1500 cm⁻¹ dengan meningkatnya waktu pemanasan. Munculnya puncak-puncak baru pada 1667 cm⁻¹ (C═N) dan 1594 cm⁻¹ (C═C─C═N), disertai dengan hilangnya pita serapan aldehida dan amina, mengonfirmasi pembentukan ikatan imina tak jenuh, yang konsisten dengan mekanisme reaksi yang diusulkan. Analisis kuantitatif menunjukkan korelasi kuat antara peningkatan luas puncak pada 1667, 1630, dan 1594 cm⁻¹ dan penurunan rasio I 460 /I 560 , yang sesuai dengan pergeseran batokromik dalam fluoresensi (Gambar 3b dan Gambar S6b ). Lebih jauh, Gambar S6c menunjukkan bahwa pergeseran batokromik dalam spektrum fluoresensi berkorelasi dengan peningkatan persentase luas puncak pada 1630 cm −1 , yang disebabkan oleh peningkatan konsentrasi turunan 3-(2-piperidil)piridinium. Spektrum Raman (Gambar S7 ) juga mengungkapkan keberadaan C═N (1640 cm −1 ) dan turunan 3-(2-piperidyl)pyridinium (1450–1600 cm −1 ).
 GAMBAR 3
GAMBAR 3
Buka di penampil gambar
Kekuatan Gambar
(a) Spektrum FTIR yang dinormalkan dari APDMS3000 1 –Glu 2 di bawah perlakuan termal yang berbeda (Gambar S4 untuk spektrum rentang penuh). (b) Hubungan antara luas puncak FTIR yang sesuai dan I 460 /I 560. (c) Spektrum 1 H-NMR dari APDMS3000 1 –Glu 2 dalam larutan kloroform terdeuterasi. (d) Spektrum 1 H-NMR dari pemantauan campuran propilamin dan glutaraldehida dalam kloroform terdeuterasi pada waktu reaksi yang berbeda. (e) Spektrum N1s XPS dari APDMS3000 1 –Glu 2 di bawah perlakuan termal yang berbeda. (f) Hubungan antara persentase luas puncak N1s XPS yang sesuai dan I 460 /I 560.
Spektroskopi NMR digunakan untuk menyelidiki evolusi struktural. Spektrum 13 C-NMR keadaan padat dari APDMS3000 1 –Glu 2 -25 °C dan APDMS3000 1 –Glu 2 -120 °C-30 menit (Gambar S8 ) menunjukkan munculnya puncak antara 100–120 ppm, yang menunjukkan transformasi turunan piridinium. Perlakuan termal pada 120 °C selama 30 menit dari APDMS3000 1 –Glu 2 juga menyebabkan hilangnya puncak karakteristik pada 64,05 dan 56,65 ppm. Sinyal-sinyal ini dapat ditetapkan ke karbon yang berdekatan dengan gugus imina (C─N═C). Hilangnya mereka berkorelasi dengan konversi progresif imina menjadi turunan piridinium. Larutan 1 H-NMR APDMS3000 1 –Glu 2 CDCl 3 diukur untuk memberikan wawasan tentang struktur molekuler, seperti yang disajikan dalam Gambar 3c . Spektrum menunjukkan hilangnya puncak aldehida ( δ = 9,74 ppm) dan munculnya puncak struktur imina terkonjugasi (─C═N─C═C─, δ = 7,62 dan 5,98 ppm) bersama dengan sejumlah kecil spesies terkonjugasi ( δ = 8,11, 9,37 ppm), konsisten dengan mekanisme reaksi yang diusulkan. Namun, pembentukan gel selama reaksi yang berkepanjangan mencegah pemantauan reaksi lebih lanjut oleh 1 H-NMR. Oleh karena itu, untuk menjelaskan asal molekuler fluoresensi nonkonvensional dari APDMS3000 1 –Glu 2 , model molekul kecil menggunakan propilamina (PA) dan glutaraldehida (PA 1 –Glu 1 ) diselidiki. PA 1 –Glu 1 menunjukkan spektrum serapan dan emisi yang mirip dengan APDMS3000 1 –Glu 2 (Gambar S9 ). Spektrum serapan tergantung waktu menunjukkan peningkatan serapan pada 360 nm seiring waktu, yang menunjukkan evolusi struktural progresif dalam PA 1 –Glu 1 (Gambar S10a,b ). Perubahan struktural yang sesuai dari PA 1 –Glu 1 dengan waktu reaksi yang berbeda diselidiki oleh 1 H-NMR (Gambar 3d dan Gambar S10c–f ). Puncak 1 H-NMR dari daerah terkonjugasi diidentifikasi sebagai imina (─C H ═N─, δ = 7,62 ppm), aldehida terkonjugasi (─C H ═C─CHO, δ = 5,85 ppm), imina terkonjugasi (─C═C─C H ═N─, δ = 7,85 ppm), N-kelompok vinil (─N─C H ═C─, δ = 5,96 ppm), dan turunan 3-(2-piperidil)piridinium ( δ = 8,23, 8,78 ppm). Analisis kuantitatif menunjukkan peningkatan bertahap dalam absorbansi 360 nm dengan waktu reaksi, yang sesuai dengan proporsi turunan 3-(2-piperidil)piridinium yang semakin besar (Gambar S10g ), kelompok N -vinil, dan imina terkonjugasi (Gambar S10h ), di samping fraksi aldehida dan imina terkonjugasi yang menurun (Gambar S10i ). Analisis spektrometri massa ionisasi elektrospray resolusi tinggi (ESI-HRMS) dari PA 1 –Glu 1 dilakukan untuk mengonfirmasi keberadaan turunan imina dan 3-(2-piperidil)piridinium (Gambar S11 ). Puncak karakteristik pada m / z 245.20157, 304.27521, 427.38042, dan 509.42261 secara jelas ditetapkan pada turunan 3-(2-piperidyl)pyridinium (Gambar S12 ).
Reaksi model antara berbagai aldehida alifatik dan amina diselidiki untuk membedakan struktur kimia spesifik yang sesuai dengan fluorofor yang berbeda. 1 H-NMR dan spektrum emisinya disajikan dalam Gambar S13 dan S14 . Analisis komparatif produk reaksi dari PA, dietilamina, dan trietilamina dengan glutaraldehida mengungkapkan bahwa hanya sistem PA yang membentuk turunan 3-(2-piperidil)piridinium, sebagaimana dibuktikan oleh 1 H-NMR. Produk unik ini menunjukkan serapan karakteristik di atas 400 nm dan emisi pada 560 nm. Sebaliknya, produk reaksi dari dietilamina dan trietilamina dengan glutaraldehida tidak menunjukkan puncak turunan 3-(2-piperidil)piridinium dalam spektrum 1 H-NMR maupun fitur serapan (>400 nm) dan emisi (>560 nm) yang sesuai. Sifat struktural dan optik dari produk reaksi PA–aldehida diselidiki secara sistematis. Produk reaksi dari PA dengan formaldehida menunjukkan fluoresensi yang berkurang, yang disebabkan oleh transformasi lebih lanjut dari imina menjadi amina tersier, sebagaimana dibuktikan oleh 1 H-NMR. Produk reaksi dari PA dengan asetaldehida menunjukkan serapan karakteristik di atas 400 nm dan emisi pada 560 nm, tetapi fluoresensi batokromik relatif lemah. Spektrum 1 H-NMR menunjukkan sinyal karakteristik turunan piridina dan gugus imina. Oleh karena itu, karakterisasi 1 H-NMR dari sistem model secara konsisten menunjukkan peran penting turunan 3-(2-piperidil)piridinium dalam memediasi fluoresensi batokromik.
Analisis XPS dilakukan untuk menyelidiki komposisi permukaan dan perubahan energi pengikatan N1s dalam APDMS3000 1 –Glu 2 selama perlakuan termal, yang memberikan wawasan lebih jauh ke dalam evolusi strukturalnya. Komposisi unsur permukaan APDMS3000 1 –Glu 2 dengan warna fluoresensi yang berbeda tetap hampir identik, yang menunjukkan bahwa komposisi unsur permukaan tidak berubah dengan pemanasan yang lama pada suhu 120°C (Gambar S15 dan Tabel S3 ). Namun, spektrum XPS N1s (Gambar 3e ) menunjukkan pergeseran halus ke arah energi pengikatan yang lebih tinggi. Setelah pemasangan multi-puncak, kurva korelasi dibuat antara persentase area dari dua puncak pemasangan (398,5 dan 399,7 eV) dan I 460 /I 560 , seperti yang digambarkan pada Gambar 3f . Ketika proporsi relatif fluorofor ( λ em = 560 nm) meningkat, proporsi intensitas puncak 398,5 eV menurun, sedangkan proporsi intensitas puncak 399,7 eV meningkat, yang menunjukkan konversi imina terkonjugasi menjadi turunan 3-(2-piperidil)piridinium, yang konsisten dengan hasil FTIR dan 1 H-NMR.
Meskipun demikian, analisis struktural di berbagai sampel dibatasi oleh fluoresensi latar belakang yang kuat, bahkan dengan eksitasi 780 nm. Karakterisasi struktural dari polisiloksan yang berikatan silang dan model molekuler mengungkapkan bahwa imina yang berasal dari glutaraldehida–amina mengalami transformasi progresif menjadi imina terkonjugasi dan turunan 3-(2-piperidil)piridinium selama pemanasan 120°C. Evolusi struktural ini berkorelasi dengan pergeseran fluoresensi batokromik yang diamati dari waktu ke waktu.
2.3 Perilaku Agregasi
Karakterisasi di atas menunjukkan bahwa fluoresensi batokromik disebabkan oleh pembentukan imina terkonjugasi dan turunan 3-(2-piperidil)piridinium. Namun, imina terisolasi, imina terkonjugasi, dan turunan 3-(2-piperidil)piridinium belum dilaporkan menunjukkan fluoresensi, yang gagal menjelaskan perubahan fluoresensi produk di bawah perlakuan termal yang berbeda. Oleh karena itu, perilaku agregasi fluorofor potensial diselidiki lebih lanjut.
Berat molekul APDMS diharapkan memengaruhi kepadatan ikatan silang secara signifikan, dengan demikian mengatur perilaku agregasi fluorofor yang berasal dari reaksi amina–aldehida. Ketika berat molekul APDMS menurun dari 25000 menjadi 1000, warna fluoresensi APDMSMn 1 -Glu 2 -120°C-10 min mengalami transisi progresif: dari biru menjadi kuning, dan akhirnya mendekati wilayah spektrum merah. Spektrum emisi yang sesuai di bawah eksitasi 400 nm dan koordinat CIE-nya disajikan pada Gambar S16a–c . Perilaku yang bergantung pada berat molekul ini muncul dari berkurangnya jarak spasial antara titik-titik ikatan silang, peningkatan kepadatan fluorofor, dan peningkatan agregasi, yang pada akhirnya mengarah pada fluoresensi batokromik. Peningkatan kandungan glutaraldehida juga meningkatkan kepadatan ikatan silang dan mendorong agregasi fluorofor. Ketika rasio glutaraldehida/APDMS ditingkatkan dari 1:1 menjadi 4:1, warna fluoresensi APDMS3000 x -Glu y -120°C-10 min berubah dari biru menjadi merah, sebagaimana dibuktikan oleh spektrum emisi dan koordinat CIE di bawah eksitasi 400 nm (Gambar S17a,b ). Hasil ini selanjutnya menunjukkan bahwa konsentrasi fluorofor yang lebih tinggi memfasilitasi agregasi, yang menyebabkan pergeseran fluoresensi batokromik.
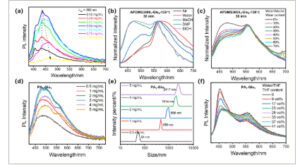
Untuk menyelidiki lebih lanjut pembentukan agregat fluorofor, spektrum emisi larutan APDMS3000 1 –Glu 2 yang bergantung pada konsentrasi diukur. Seperti yang ditunjukkan pada Gambar 4a , intensitas emisi pada 450 nm ( λ ex = 360 nm) awalnya meningkat ketika konsentrasi larutan ditingkatkan secara bertahap tetapi menurun setelah konsentrasi melampaui 0,94 mg/mL, disertai dengan hilangnya struktur spektrum halus. Sementara itu, fluoresensi batokromik diamati dengan meningkatnya konsentrasi, yang merupakan karakteristik khas fluoresensi yang diinduksi gugus nonkonvensional [ 18 ].
 GAMBAR 4
GAMBAR 4
Buka di penampil gambar
Kekuatan Gambar
(a) Spektrum emisi larutan APDMS3000 1 –Glu 2 /THF pada berbagai konsentrasi yang dieksitasi pada 360 nm. (b) Spektrum emisi ternormalisasi APDMS 1 -Glu 2 -120°C-30 menit (keadaan padat) yang direndam dalam berbagai pelarut yang dieksitasi pada 400 nm. (c) Spektrum emisi ternormalisasi APDMS 1 -Glu 2 -120°C-30 menit (keadaan padat) yang direndam dalam air/EtOH dengan rasio pencampuran yang berbeda yang dieksitasi pada 400 nm. (d) Spektrum emisi dispersi THF PA 1 –Glu 1 pada berbagai konsentrasi yang dieksitasi pada 400 nm. (e) Ukuran agregasi dispersi THF PA 1 –Glu 1 dengan berbagai konsentrasi. (f) Spektrum emisi 0,5 mg/mL PA 1 –Glu 1 terprotonasi dalam dispersi air/THF dengan rasio berbeda yang tereksitasi pada 400 nm.
Efek pelarut pada sifat emisi APDMS3000 1 –Glu 2 selanjutnya mengonfirmasi pendaran batokromik yang diinduksi agregat, yang juga mengecualikan pembentukan titik silikon di bawah perlakuan termal. APDMS3000 1 –Glu 2 -120°C-30 menit (I 460 /I 560 = 0,4 di udara, λ ex = 400 nm) direndam dalam berbagai pelarut untuk mengamati perubahan dalam spektrum emisinya. Gambar 4b menunjukkan bahwa I 460 /I 560 meningkat dengan polaritas pelarut dan rasio pembengkakan polisiloksan [ 47 ]. Hal ini menunjukkan bahwa pembengkakan yang diinduksi pelarut mengurangi agregasi fluorofor, sehingga menyebabkan pendaran batokromik. Lebih jauh lagi, I460 / I560 dari APDMS3000 1 – Glu2 -120°C-30 menit menurun secara progresif ketika pelarut miskin H2O secara bertahap ditambahkan ke etanol (EtOH), seperti yang diilustrasikan pada Gambar 4c . Pengenalan pelarut miskin menginduksi agregasi fluorofor dalam matriks polisiloksan yang terikat silang, sehingga meningkatkan fluoresensi batokromik.
Selain itu, luminesensi batokromik yang diinduksi agregat juga diverifikasi dengan menggunakan model molekuler. Larutan PA 1 –Glu 1 THF menunjukkan emisi yang bergantung pada konsentrasi yang jelas (Gambar 4d ). Intensitas emisi pada 460 nm ( λ ex = 400 nm) awalnya meningkat dan kemudian menurun setelah konsentrasi melampaui 3 mg/mL, disertai dengan munculnya puncak bahu pada 560 nm. Hamburan cahaya dinamis (DLS) digunakan untuk memantau variasi dalam ukuran agregasi sebagai fungsi dari peningkatan konsentrasi, seperti yang ditunjukkan pada Gambar 4e . Peningkatan yang diamati dalam ukuran agregasi dengan meningkatnya konsentrasi menguatkan pergeseran batokromik dalam fluoresensi yang terkait dengan agregasi fluorofor. Larutan PA 1 –Glu 1 berair juga menunjukkan fluoresensi batokromik yang diinduksi agregasi ketika pH disesuaikan dari kondisi asam ke basa. Spektrum serapan larutan berair PA 1 –Glu 1 (seperti yang ditunjukkan pada Gambar S18 ) mengungkapkan perubahan minimal yang bergantung pada pH. Sebaliknya, spektrum emisi menunjukkan variasi respons pH yang signifikan. Perilaku fluoresensi yang berbeda ini muncul dari perubahan kelarutan yang dimodulasi pH melalui protonasi/deprotonasi PA 1 –Glu 1 , yang mengatur keadaan agregasi. Untuk lebih memvalidasi mekanisme batokromik yang diinduksi agregasi ini, eksperimen agregasi yang diinduksi pelarut yang buruk juga dilakukan. Ketika THF diperkenalkan sebagai pelarut yang buruk, warna fluoresensi larutan PA 1 –Glu 1 yang terprotonasi secara bertahap berubah (Gambar 4f dan Gambar S19 ), disertai dengan perilaku agregasi bersamaan. Penurunan I 460 /I 560 mengonfirmasi mekanisme batokromik yang diinduksi agregasi.
2.4 Simulasi Komputasional dan Pembahasan
Perhitungan kimia kuantum dilakukan untuk menentukan tingkat energi HOMO–LUMO dan transisi lubang-elektron keadaan tereksitasi dari struktur ikatan silang yang disederhanakan (Gambar 5 , Gambar S20 , dan Tabel S4 ). Untuk imina terkonjugasi, jenis transisi keadaan dasar dan keadaan tereksitasi sangat mirip dengan transisi π–π*. Sebaliknya, untuk turunan 3-(2-piperidil)piridinium, transisi keadaan dasar ke keadaan tereksitasi menunjukkan karakteristik perpindahan muatan seperti yang dikonfirmasi oleh analisis lubang-elektron. Energi eksitasi vertikal yang disimulasikan adalah 378 nm, selaras dengan hasil eksperimen. Selain itu, saat dimer turunan 3-(2-piperidil)piridinium semakin dekat, mode perpindahan muatan berpindah dari perpindahan muatan intramolekul menjadi intermolekul, yang menyebabkan puncak eksitasi yang disimulasikan bergeser ke 406 nm, yang sesuai dengan pergeseran batokromik yang diamati dalam fluoresensi dalam percobaan.
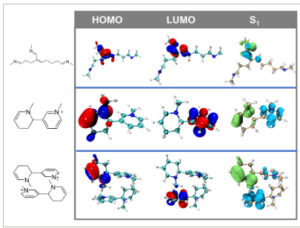 GAMBAR 5
GAMBAR 5
Buka di penampil gambar
Kekuatan Gambar
Distribusi elektron orbital HOMO–LUMO dan distribusi lubang-elektron dalam keadaan tereksitasi tunggal dari struktur ikatan silang yang disederhanakan.
Tingkat energi HOMO–LUMO dan transisi lubang-elektron keadaan tereksitasi dari struktur ikatan silang sederhana yang mengandung subunit siloksana juga dihitung untuk mengevaluasi efek penggabungan siloksana pada perilaku agregasi dan konjugasi melalui ruang (Gambar S21 dan S22 ). Untuk imina terkonjugasi dan turunan 3-(2-piperidil)piridinium, pengenalan subunit siloksana menunjukkan dampak yang dapat diabaikan pada delokalisasi elektronik, dengan energi eksitasi vertikal yang dihitung tetap hampir tidak berubah. Ini menunjukkan bahwa unit dimetilsiloksana hampir tidak berpartisipasi dalam delokalisasi elektronik. Namun, ketika mempertimbangkan konformasi dimer, halangan sterik dari subunit siloksana meningkatkan pemisahan spasial antara gugus turunan piridinium. Analisis elektron-lubang lebih lanjut mengungkapkan bahwa dimer mempertahankan karakteristik transfer muatan intramolekul, yang menunjukkan bahwa subunit siloksana menekan agregasi fluorofor nonkonvensional. Pengamatan ini sejalan dengan hasil eksperimen: APDMS3000 1 –Glu 2 -25°C yang berikatan silang memancarkan fluoresensi biru di bawah lampu UV, sedangkan PA 1 –Glu 1 menunjukkan emisi merah. Ini menunjukkan bahwa penggabungan PDMS menghambat pembentukan agregat dengan karakteristik konjugasi melalui ruang. Namun, setelah perlakuan termal, peningkatan konsentrasi fluorofor yang terlokalisasi dan suhu yang tinggi dapat secara sinergis mendorong pembentukan agregat, mendekati keadaan agregasi yang diamati pada PA 1 –Glu 1 , sehingga memungkinkan emisi batokromik.
Berdasarkan karakterisasi struktural, fluoresensi polisiloksan ikatan silang dikaitkan dengan imina terkonjugasi dan turunan 3-(2-piperidil)piridinium pada titik ikatan silang yang dibentuk oleh reaksi glutaraldehida dan amina. Lebih lanjut disimpulkan bahwa fluorofor yang memancarkan di atas 560 nm sesuai dengan agregat turunan 3-(2-piperidil)piridinium. Mekanisme yang diusulkan dari APDMS3000 1 –Glu 2 yang dapat disetel penuh warna diilustrasikan pada Gambar 6. Transfer muatan intramolekul dan intermolekul dari fluorofor tidak konvensional yang baru, turunan 3-(2-piperidil)piridinium, sangat penting untuk fluoresensi batokromik.
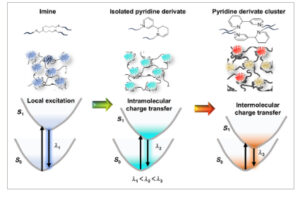
GAMBAR 6
Buka di penampil gambar
Kekuatan Gambar
Mekanisme yang diusulkan dari APDMS3000 1 –Glu 2 yang dapat disetel penuh warna .
Dibandingkan dengan PA 1 –Glu 1 , APDMS-Glu menunjukkan kontrol yang tepat atas konversi dan agregasi turunan 3-(2-piperidyl)pyridinium dalam keadaan padat, yang memungkinkan pengaturan berkelanjutan emisi warna penuh melalui perlakuan termal (Gambar S23 ). PA 1 –Glu 1 membentuk produk padat fluoresensi merah setelah penguapan pelarut pada suhu ruangan. Warna emisinya sulit diatur. Sebaliknya, kontrol yang tepat atas rasio konversi imina menjadi turunan 3-(2-piperidyl) pyridinium pada titik ikatan silang dan transformasi keadaan agregasinya dalam APDMS-Glu melalui konstruksi jaringan polisiloksan ikatan silang dan modulasi parameter yang sistematis termasuk suhu perlakuan termal (120°C–180°C), durasi (5–30 menit), berat molekul polisiloksan (M n : ∼248–25.000), dan rasio aldehida/gugus amino (1/4). Hal ini memungkinkan penyetelan fluoresensi berkelanjutan APDMS-Glu dari biru ke merah.
2.5 Perilaku Elastis dan Aplikasi Fungsional
APDMS3000 1 –Glu 2 tidak hanya menunjukkan sifat fluoresensi yang sangat baik tetapi juga perilaku elastomerik intrinsik. Perpanjangan saat putus APDMS3000 1 –Glu 2 lebih dari 100%, dan tidak ada variasi signifikan dalam modulus tarik di bawah perlakuan termal yang berbeda. Foto sampel yang diregangkan di bawah sinar UV 365 nm dan perilaku tarik APDMS3000 1 –Glu 2 fluoresen ditunjukkan pada Gambar 7a dan Gambar S24 . Meskipun perlakuan termal menyebabkan perubahan warna fluoresen dan struktur ikatan silang, dampaknya pada sifat mekanis relatif kecil. Stabilitas fluoresen di bawah berbagai perpanjangan tarik dievaluasi, seperti yang ditunjukkan pada Gambar S24b . Di bawah sinar UV 365 nm, warna fluoresen tetap tidak berubah bahkan ketika perpanjangan tarik melebihi 100%. Spektrum emisi menunjukkan bahwa rasio I 460 / I 560 tetap hampir konstan selama peregangan, yang menunjukkan bahwa APDMS3000 1 –Glu 2 menunjukkan stabilitas optik yang sangat baik di bawah peregangan uniaxial, menjadikannya kandidat yang menjanjikan sebagai lapisan pengubah cahaya yang fleksibel dan dapat diregangkan.
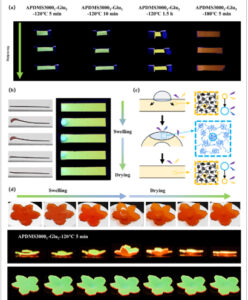 GAMBAR 7
GAMBAR 7
Buka di penampil gambar
Kekuatan Gambar
(a) Foto APDMS3000 1 –Glu 2 yang disiapkan melalui berbagai perlakuan termal selama proses peregangan di bawah sinar UV 365 nm. (b) Foto deformasi searah reversibel dan perubahan warna fluoresensi APDMS3000 1 –Glu 2 yang sesuai saat distimulasi oleh tetesan THF. (c) Skema pembengkakan lokal polisiloksan yang terikat silang yang menyebabkan deformasi searah. (d) Foto yang mengilustrasikan mekarnya bunga buatan yang dipicu oleh tetesan THF dan pemulihannya selanjutnya dengan penguapan pelarut.
Polisiloksan yang terikat silang telah berhasil diimplementasikan dalam material pintar yang responsif terhadap pelarut karena perilaku deformasi yang diinduksi pembengkakan in situ [ 48 , 49 ]. APDMS3000 1 –Glu 2 juga menunjukkan efek ini dan, dikombinasikan dengan perilaku solvatokromiknya, dapat memperluas aplikasi material fluoresensi nonkonvensional secara signifikan. Deformasi responsif dan perilaku perubahan warna yang diinduksi pelarut dari APDMS3000 1 –Glu 2 ditunjukkan pada Gambar 7b–d . Kontak tetesan THF memicu pembengkakan dan deformasi lokal, disertai dengan agregasi fluorofor yang berkurang, yang menyebabkan daerah yang membengkak mengalami transisi fluoresensi dari kuning menjadi biru. Lebih jauh lagi, ketika APDMS3000 1 –Glu 2 dipotong menjadi bentuk bunga dan tetesan diterapkan ke posisi di bawah bagian tengah, ia menunjukkan perilaku mekar dan pemulihan. Perilaku ini tidak hanya meniru proses mekar alami tetapi juga berfungsi sebagai indikator area pembasahan pelarut dan penguapan tetesan.
3 Kesimpulan
Singkatnya, polisiloksan ikatan silang fluoresen disintesis menggunakan polisiloksan berujung amino dan glutaraldehida. Puncak emisi polisiloksan ikatan silang dapat terus disetel dalam kisaran 450–600 nm melalui perlakuan termal yang mudah dan terkendali dalam satu sistem material. Transformasi titik ikatan silang dari imina menjadi turunan 3-(2-piperidil)piridinium selama proses pemanasan dijelaskan berdasarkan karakterisasi sifat optik dan perubahan struktural polisiloksan ikatan silang. Fluoresensi APDMS 1 -Glu 2 yang bergantung pada konsentrasi dan bergantung pada pelarut selanjutnya menegaskan bahwa transfer muatan intramolekul dan intermolekul dari fluorofor turunan 3-(2-piperidil)piridinium nonkonvensional yang baru berkontribusi secara signifikan terhadap fluoresensi batokromik yang diinduksi oleh agregasi. Kontrol yang tepat atas evolusi struktural fluorofor, memungkinkan penyetelan warna emisi yang berkelanjutan dan luas.
Sementara itu, potensi aplikasi material dalam sistem cerdas dan responsif ditunjukkan dengan memanfaatkan sepenuhnya perilaku elastis dan karakteristik deformasi solvatokromiknya, yang membuka jalan bagi inovasi dalam bidang seperti sensor, pengemasan cerdas, dan lainnya. Secara keseluruhan, studi kami tidak hanya menjelaskan lebih lanjut mekanisme dasar fluoresensi nonkonvensional tetapi juga memberikan prinsip panduan alternatif untuk desain material fluoresensi nonkonvensional yang dapat diatur warnanya.
4 Bagian Eksperimen
4.1 Bahan dan Reagen
Telechelic 3-APDMS: APDMS1000 (Mn: 900–1000 g mol −1 ), APDMS3000 (Mn: 3000 g mol −1 ), APDMS25000 (Mn: 25000 g mol −1 ) dibeli dari Gelest. Larutan glutaraldehida (50 wt% dalam air) dan dietilamina dibeli dari Aldrich. PA dibeli dari Thermo Scientific. Trietilamina dibeli dari Alfa Aesar. Pelarut kemurnian kromatografi, termasuk metanol (MeOH), EtOH, THF, diklorometana (DCM), dan N , N -dimetilformamida (DMF), dibeli dari Concord. Kloroform- d (CDCl 3 ) untuk karakterisasi NMR dibeli dari Innochem. Semua reagen digunakan sebagaimana diterima.
4.2 Instrumen dan Metode Karakterisasi
Spektrum 1H-NMR diukur dengan spektrometer NMR AVANCE III 400 HD (Bruker) dan Fourier 300 (Bruker) dalam CDCl3 ( referensi internal tetramethyl silane) pada suhu kamar. Spektrum NMR 13C solid-state diukur dengan AVANCE III 400 (Bruker). ESI-HRMS diukur dengan spektrometer massa transformasi Fourier 9,4 T (Bruker Solarix). Spektrum FTIR direkam dengan spektrometer VERTEX 70v (Bruker) menggunakan metode cakram KBr. Spektrum emisi diperoleh dengan spektrometer fluoresensi FluoroMax+ (Horiba). Hasil kuantum dan waktu hidup PL diukur dengan spektrometer fluoresensi FLS980 (Edinburgh). Spektrum UV–vis diukur dengan spektrofotometer UV–vis/NIR Lambda 1050+ (Perkin Elmer). Spektrum XPS diukur dengan ESCALAB250XI (spektrum UV–vis diukur dengan). Kurva tegangan-regangan diukur dengan INSTRON 3365 (INSTRON). Spektrum Raman diukur dengan mikrospektrometer Raman (Horiba).
4.3 Sintesis Polisiloksan Berikatan Silang
APDMS3000 1 –Glu 2 -120°C-5 menit sebagai contoh, APDMS3000 (1 mmol) dilarutkan dalam 3 mL THF, kemudian larutan glutaraldehida THF (400 mg 50 wt% glutaraldehida (2 mmol) dalam air yang diencerkan dengan 3 mL THF) ditambahkan ke dalam larutan. Larutan diaduk selama 20 menit pada suhu ruangan, berubah menjadi kuning muda. Kemudian, larutan dituangkan ke dalam cetakan Teflon, dan pelarut diuapkan semalaman untuk memperoleh polisiloksan yang terikat silang. APDMS3000 1 –Glu 2 -120°C-5 menit disiapkan dengan memanaskan polisiloksan yang terikat silang pada suhu 120°C selama 5 menit.
4.4 Persiapan Solusi APDMS30001–Glu2
APDMS3000 (1 mmol) dilarutkan dalam 3 mL THF, kemudian larutan THF glutaraldehida (2 mmol glutaraldehida (400 mg 50 wt% glutaraldehida dalam air yang diencerkan dengan 3 mL THF) ditambahkan ke dalam larutan. Larutan diaduk selama 1 jam pada suhu ruangan, berubah menjadi kuning, kemudian diencerkan dengan cepat hingga mencapai konsentrasi yang diinginkan dan segera digunakan untuk pengujian berikutnya. Untuk setiap pengujian, larutan APDMS3000 1 –Glu 2 disiapkan baru sebelum digunakan.
4.5 Reaksi Amina Molekul Kecil dan Aldehida
PA 1 –Glu 1 sebagai contoh, propilamina (1 mmol) dilarutkan dalam 3 mL THF, kemudian larutan glutaraldehida THF (200 mg 50 wt% glutaraldehida (1 mmol) dalam air yang diencerkan dengan 3 mL THF) ditambahkan ke dalam larutan tersebut. Larutan tersebut diaduk pada suhu ruangan, dan pelarutnya diuapkan untuk memperoleh PA 1 –Glu 1 . Berbagai amina juga bereaksi dengan berbagai aldehida pada rasio molar amino/aldehida sebesar 1:2 pada suhu ruangan. Pelarut lain juga digunakan untuk reaksi antara amina dan aldehida.
4.6 Studi Perhitungan Teoritis
Semua perhitungan dilakukan dengan perangkat lunak Gaussian 16 A.03 [ 50 ]. Optimasi geometri struktur ikatan silang sederhana yang dibentuk oleh amina dan glutaraldehida dihitung pada level teori CAM-B3LYP [ 51 ]/6-31G(d) [ 52 , 53 ] yang dikombinasikan dengan koreksi dispersi Grimme’s D3(BJ) [ 54 , 55 ]. Energi transisi vertikal dari 50 keadaan tereksitasi pertama dihitung menggunakan teori fungsional kerapatan bergantung waktu (TD-DFT) pada level TD-CAM-B3LYP-D3(BJ)/def2-TZVP [ 56 , 57 ]. Model kontinum terpolarisasikan (PCM) [ 58 ] model solvasi implisit digunakan untuk memperhitungkan efek solvasi PDMS ( ε = 2,7) pada saat yang sama. Analisis keadaan tereksitasi lubang-elektron dilakukan dengan Multiwfn 3.8 (dev) [ 59 – 61 ]. VMD 1.9.3 [ 62 ] digunakan untuk memvisualisasikan tingkat energi dan distribusi lubang-elektron.
