ABSTRAK
Meningkatnya prevalensi Staphylococcus aureus yang resistan terhadap methicillin (MRSA) akibat penyalahgunaan antibiotik memerlukan strategi terapi baru untuk melawan infeksi yang resistan terhadap banyak obat. Di sini, kami memperkenalkan platform nanostruktur DNA tetrahedral (tFNA) yang dirakit sendiri dan ditingkatkan agregasinya yang mencapai pengiriman obat yang ditargetkan melalui agregasi terkontrol dan pelepasan berkelanjutan, yang secara efektif memulihkan kerentanan MRSA terhadap antibiotik β-laktam. Kerangka tetrahedral ini, disebut tFNA-ASO-ceftriaxone sodium (TAC), berfungsi sebagai sistem fungsional ganda yang secara bersamaan membungkus oligonukleotida antisense (ASO) yang menargetkan gen mecA dan antibiotik β-laktam ceftriaxone sodium (Cef). Agregasi TAC memainkan peran penting dalam memaksimalkan retensi dan stabilitas obat, memperpanjang pelepasan ASO dan antibiotik secara lokal sambil mempertahankan bioavailabilitas yang tinggi di lokasi infeksi. Studi karakterisasi, termasuk distribusi ukuran, potensi zeta, dan uji fluoresensi quenching, mengonfirmasi stabilitas agregasi dan efisiensi enkapsulasi yang kuat, memastikan kinetika obat yang terkendali dan efek terapeutik yang berkepanjangan. Setelah berinteraksi dengan sel bakteri, TAC yang terkonsentrasi secara lokal memfasilitasi pembungkaman mecA yang dimediasi ASO secara efisien , sehingga mengganggu ekspresi PBP2a dan membuat MRSA kembali peka terhadap β-laktam. Secara bersamaan, reservoir natrium seftriakson yang teragregasi memastikan penghambatan berkelanjutan sintesis dinding sel bakteri, yang mengarah pada pembersihan bakteri yang efektif. Selain itu, TAC menunjukkan aktivitas antibiofilm yang kuat dengan menembus matriks biofilm dan memberikan terapi langsung ke populasi bakteri yang tertanam, sehingga mengatasi hambatan difusi. In vivo, TAC menunjukkan kemanjuran terapeutik yang unggul dalam model tikus pneumonia yang diinduksi MRSA, secara signifikan meningkatkan tingkat kelangsungan hidup, mengurangi beban bakteri, dan mengurangi kerusakan jaringan paru-paru. Temuan ini menyoroti potensi transformatif tFNA sebagai sistem agregasi dan pelepasan obat yang cerdas, menawarkan paradigma baru untuk mengoptimalkan terapi antibiotik terhadap patogen yang resistan terhadap banyak obat.
Singkatan
AFM
mikroskopi gaya atom
ASO (Asosiasi Perusahaan ASO)
oligonukleotida antisense
ATCC
Koleksi Budaya Tipe Amerika
cef-ku
seftriakson
CISI
Lembaga Standar Klinis dan Laboratorium
KLSM
mikroskopi pemindaian laser confocal
Bahasa Inggris Cy5
sianin-5
Bahasa Inggris DLS
hamburan cahaya dinamis
Bahasa Inggris MBC
konsentrasi bakterisida minimum
Bahasa Inggris MBEC
konsentrasi pemberantasan biofilm minimum
Bahasa Indonesia: MBIC
konsentrasi penghambat biofilm minimum
mikrofon
konsentrasi penghambatan minimum
Penyakit MRSA
Staphylococcus aureus yang resistan terhadap metisilin
PBP2a
protein pengikat penisilin 2a
Bakteri S. aureus
Stafilokokus aureus
Bahasa Indonesia
tFNA-ASO
TAK
tFNA-ASO-seftriakson
TC
tFNA-ceftriaxone
Tes FNA
nanostruktur DNA tetrahedral
1 Pendahuluan
Methicillin-resistant Staphylococcus aureus (MRSA) adalah patogen yang sangat virulen yang menimbulkan risiko kesehatan yang signifikan karena resistensinya terhadap berbagai antibiotik konvensional, termasuk methicillin, penisilin, dan β-laktam lainnya [ 1 ]. Resistensi ini sangat membatasi pilihan pengobatan, membuat infeksi MRSA sangat menantang untuk ditangani dan sering kali mengakibatkan kondisi yang mengancam jiwa seperti pneumonia, infeksi aliran darah, sepsis, dan endokarditis [ 2 , 3 ]. Sebagai penyebab utama infeksi yang didapat di rumah sakit, MRSA sering kali berkontribusi terhadap lama tinggal di rumah sakit, peningkatan biaya medis, dan tingkat kematian yang lebih tinggi. Selain itu, meningkatnya prevalensi infeksi MRSA yang didapat di masyarakat telah semakin mempersulit upaya untuk mengendalikan penyebarannya, yang menyoroti kebutuhan mendesak akan strategi pencegahan dan pengobatan yang efektif [ 4 ].
Ceftriaxone sodium, sefalosporin generasi ketiga, telah digunakan secara luas untuk mengobati berbagai infeksi bakteri karena aktivitas spektrum luasnya terhadap berbagai bakteri Gram-negatif dan Gram-positif, termasuk S. aureus [ 5 ]. Namun, efikasinya terhadap MRSA sangat terganggu karena bakteri tersebut memproduksi PBP2a [ 6 ], protein pengikat penisilin yang dikodekan oleh gen mecA , yang memberikan resistensi terhadap antibiotik β-laktam. Meskipun ada upaya yang sedang berlangsung, pengembangan obat antimikroba baru sebagian besar masih bergantung pada sintesis de novo atau penyaringan dan modifikasi produk alami; namun kemajuan di bidang ini hampir mandek. Yang memperparah masalah, penggunaan antibiotik yang berlebihan terus mendorong evolusi strain yang resistan, sehingga mengurangi efektivitas antibiotik alternatif seperti vankomisin, daptomycin, atau linezolid. Tantangan yang berkembang ini memerlukan pengembangan strategi terapi baru dan agen antimikroba untuk memerangi patogen yang tangguh ini. Pendekatan yang menjanjikan, seperti terapi kombinasi antibiotik dan terapi berbasis asam nukleat, sedang dieksplorasi untuk meningkatkan kemanjuran antibiotik yang ada terhadap strain bakteri yang resistan [ 6 , 7 ].
Terapi antisense oligonucleotide (ASO) memiliki potensi signifikan dalam pengobatan anti-infeksi dengan menargetkan sekuens RNA spesifik patogen untuk menghambat ekspresi gen esensial yang diperlukan untuk kelangsungan hidup dan virulensi patogen. Melalui pengikatan spesifik sekuens [ 8 ], ASO dapat dirancang untuk memblokir translasi atau meningkatkan degradasi mRNA patogen yang responsif terhadap fungsi infeksi kritis, seperti pembentukan biofilm, produksi toksin, dan mekanisme resistensi antibiotik. Pendekatan ini membuat patogen lebih rentan terhadap sistem imun inang atau antibiotik konvensional sambil meminimalkan efek di luar target pada inang. Terapi ASO menawarkan strategi yang sangat spesifik dan dapat disesuaikan untuk memerangi infeksi, terutama yang disebabkan oleh organisme yang resistan terhadap banyak obat seperti MRSA. Khususnya, ASO yang menargetkan gen mecA secara khusus dapat menghambat ekspresi PBP2a, memulihkan kerentanan MRSA terhadap antibiotik β-laktam konvensional dan menunjukkan potensi terapi ASO dalam memerangi infeksi MRSA [ 9 ]. Namun, aplikasi klinis ASO terus menghadapi tantangan yang signifikan, termasuk penyerapan seluler yang terbatas dan stabilitas yang buruk dalam lingkungan biologis, yang menekankan perlunya sistem pengiriman yang efisien dan kuat untuk sepenuhnya membuka potensi terapeutiknya. Pendekatan yang efektif melibatkan pembentukan agregat skala nano atau mikro dengan molekul lain untuk melindungi asam nukleat dari degradasi enzimatik dan meningkatkan penyerapan selulernya melalui endositosis. Misalnya, agregat berbasis lipid (misalnya, nanopartikel lipid, liposom, dan lipoplex) dan agregat berbasis polimer (misalnya, dendrimer, poliplex, dan hidrogel) telah banyak digunakan untuk memberikan terapi asam nukleat yang meningkatkan stabilitasnya, penyerapan seluler, dan kemanjuran terapi secara keseluruhan. Namun, sistem pengiriman berbasis lipid sering menghadapi tantangan seperti ketidakstabilan dalam cairan biologis dan imunogenisitas [ 10 ], sedangkan kendaraan berbasis polimer berjuang dengan toksisitas, sintesis kompleks, dan biodegradabilitas terbatas [ 11 , 12 ].
Dengan kemajuan pesat nanoteknologi DNA selama beberapa dekade terakhir [ 13 – 15 ], nanostruktur DNA/RNA, khususnya asam nukleat kerangka (FNA), telah menarik perhatian signifikan sebagai pembawa obat serbaguna karena sifat uniknya sebagai agregat supramolekul yang dapat diprogram [ 16 , 17 ]. FNA terbentuk melalui hibridisasi tepat beberapa molekul DNA, menghasilkan arsitektur yang kompak, stabil, dan sangat terkontrol. Tidak seperti agregat acak yang terbentuk oleh interaksi nonspesifik [ 18 ], FNA menunjukkan prediktabilitas struktural dan adaptabilitas dinamis, memungkinkan kinerja yang unggul dibandingkan dengan nanocarrier konvensional [ 19 ]. Arsitektur skala nano mereka memfasilitasi penyerapan seluler melalui endositosis, sedangkan pengemasannya yang padat melindungi terhadap degradasi enzimatik, meningkatkan stabilitasnya dalam lingkungan biologis. Selain itu, sifat asam nukleat intrinsiknya memungkinkan regulasi gen dan pengiriman obat secara simultan, menjadikannya sangat berharga dalam mengobati infeksi dan kanker yang resistan terhadap obat [ 20 ]. Mereka sangat cocok untuk memberikan terapi berbasis asam nukleat, seperti ASO, siRNA, dan saRNA, karena kompatibilitasnya yang inheren dengan asam nukleat, memungkinkan pemuatan obat yang nyaman melalui pasangan basa atau hubungan kovalen [ 21 ]. Sifat permukaannya yang dapat disetel juga memfasilitasi fungsionalisasi dengan molekul kecil, peptida, atau protein. Misalnya, obat molekul kecil dapat diintegrasikan melalui berbagai mekanisme pengikatan, seperti interkalasi, pengikatan alur, interaksi elektrostatik, dan interaksi hidrofobik, memastikan pemuatan obat yang efisien dan stabil [ 22 ]. Selain itu, kendaraan berbasis asam nukleat ini menunjukkan biokompatibilitas yang sangat baik, biodegradabilitas, dan imunogenisitas rendah, mengurangi risiko efek samping. Dengan memanfaatkan keunggulan ini, FNA menyediakan platform serbaguna untuk pengiriman bersama terapi asam nukleat dan obat molekul kecil, memungkinkan hasil terapi yang sinergis [ 23 , 24 ]. Dalam konteks pengobatan MRSA, FNA memiliki potensi besar dalam memberikan ASO dalam kombinasi dengan antibiotik, sehingga meningkatkan kemanjuran antibakteri melalui strategi multi-target.
Dalam studi ini, kami merekayasa FNA tetrahedral (tFNA) yang dikontrol secara konformasi [ 25 ] yang dikonjugasikan dengan ASO yang menargetkan mecA dan dienkapsulasi dengan natrium seftriakson, menghasilkan kompleks antimikroba terapeutik (TAC) yang sangat efisien dan stabil. Sifat agregasi unik dari tFNA ini memungkinkan enkapsulasi ketat dan pengiriman simultan dari ASO dan natrium seftriakson, memaksimalkan efek sinergisnya [ 26 , 27 ]. Perakitan mandiri TAC yang digerakkan oleh agregasi meningkatkan stabilitas, kapasitas pemuatan, dan pelepasan berkelanjutan, yang secara signifikan menurunkan ekspresi PBP2a, memulihkan kerentanan MRSA terhadap antibiotik β-laktam dan secara substansial meningkatkan kemanjuran bakterisida natrium seftriakson (Abstrak Grafis). Pendekatan perintis ini, didorong oleh agregasi obat-obatan dalam nanostruktur tunggal, tidak hanya menambah potensi antibiotik yang ada tetapi juga menawarkan strategi yang menjanjikan untuk mengatasi tantangan berat yang ditimbulkan oleh MRSA, membuka jalan bagi perawatan yang lebih efektif dalam memerangi patogen yang resistan terhadap banyak obat.
2 Bahan dan Metode
2.1 Sintesis tFNA dan Pemuatan Obat
DNA untai tunggal (ssDNA) disintesis dan dimurnikan oleh Sangon (Shanghai, Cina) dan disimpan dalam 1× phosphate-buffered saline (PBS). Urutan nukleotida setiap untai ditunjukkan pada Tabel S1 . tFNA disintesis seperti yang dijelaskan sebelumnya [ 28 ]. Secara singkat, 1 µM dari masing-masing empat atau lima ssDNA ditambahkan ke buffer TM (20 mM Tris, 50 mM MgCl 2 , pH 8,0). Sampel dipusarkan dengan lembut, dipanaskan hingga 95 °C selama 10 menit, didinginkan dengan cepat hingga 4 °C, dan disimpan dalam thermal cycler selama 20 menit untuk membentuk tFNA atau tFNA-mecA. Untuk mensintesis TAC atau tFNA-ceftriaxone (TC), larutan natrium ceftriaxone dan tFNA atau tFNA-mecA (100 nM) diinkubasi pada suhu 4°C selama 1 hari. Primer yang digunakan untuk mensintesis berbagai bahan tetrahedral tercantum dalam Tabel S2 . Campuran tersebut kemudian ditambahkan ke tabung ultrafiltrasi 15 kD dan disentrifugasi pada 10.000 rpm selama 10 menit untuk memisahkan natrium ceftriaxone tak terkonjugasi dan ssDNA.
Selain itu, efisiensi pemuatan tFNA atau TC dihitung berdasarkan luas puncak natrium seftriakson. Efisiensi pemuatan natrium seftri
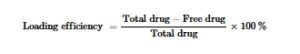
2.2 Identifikasi TAC Hasil Sintesis
Elektroforesis gel poliakrilamid (PAGE) pada 8% digunakan untuk memverifikasi keberhasilan konstruksi TAC. Mikroskopi gaya atom (AFM) (Cypher VRS, Oxford Instruments, Inggris) digunakan untuk mengamati morfologi nanomaterial dalam TAC. Eksperimen hamburan cahaya dinamis (DLS) dan potensi zeta dilakukan pada suhu 25°C menggunakan instrumen Malvern Zetasizer-Nano ZS90 untuk memperoleh data distribusi ukuran untuk tFNA-mecA atau TAC.
2.3 Kurva Standar untuk Ceftriaxone (Cef)
Nilai absorbansi larutan Cef pada konsentrasi 25, 50, 100, 200, 300, dan 400 µg/mL diukur melalui spektrofotometer ultramikro (NANODROP 2000C, Thermo Fisher). Kurva standar dibuat dengan pengukuran ini melalui perangkat lunak Prism.
2.4 Penilaian Beban Cef
Setiap sampel (Cef, TA, dan TAC) dianalisis menggunakan alikuot 2 µL pada spektrofotometer ultramikro (NanoDrop 2000C, Thermo Fisher). Pemindaian panjang gelombang penuh dilakukan untuk mengidentifikasi puncak serapan karakteristik setiap sampel, sehingga memungkinkan diferensiasi yang jelas antara Cef, TA, dan TAC.
2.5 Studi Pelepasan In Vitro Cef dan TAC
Membran dialisis (25 kDa, Shyuanye, Shanghai, Tiongkok) digunakan untuk membagi media pelepasan menjadi larutan bagian dalam (3 mL) dan larutan bagian luar (30 mL). PBS (0,01 mol/L, pH 7,4) berfungsi sebagai media pelepasan. Larutan bagian dalam berisi Cef atau TAC yang terlarut dan dipertahankan pada suhu 37°C dengan pengadukan lembut untuk meniru proses pelepasan obat. Pada titik waktu yang ditentukan (2, 4, 6, 12, 24, dan 48 jam), 2 µL sampel dikumpulkan dari larutan bagian luar. Kepadatan optik (OD) pada 242 nm diukur untuk mengukur Cef yang dilepaskan, sehingga memudahkan evaluasi efisiensi pelepasan obat dari waktu ke waktu.
2.6 Pelepasan TAC Intraseluler pada S. aureus
Bakteri dikulturkan hingga OD 600 sebesar 0,5, diikuti dengan penambahan TAC. Setelah pencampuran menyeluruh, suspensi diinkubasi pada suhu 37°C selama 3 jam. Titik ini ditetapkan sebagai “0 jam”, setelah itu inkubasi dilanjutkan. Sampel dikumpulkan pada jam ke-2, ke-4, dan ke-6, dicuci dengan PBS untuk menghilangkan obat ekstraseluler, dan dilisis menggunakan lisozim. Lisat disentrifugasi, dan supernatan disaring menggunakan tabung ultrafiltrasi 10 kDa. Retentat, yang mewakili TAC yang belum dilepaskan, diukur dengan absorbansi pada 242 nm dan dihitung menggunakan kurva standar ceftriaxone. Cef yang dilepaskan ditentukan dengan mengurangi obat yang tertahan dari pemuatan awal.
2.7 Sel Eukariotik dan Kultur Bakteri
Garis fibroblas tikus L929 dikulturkan dalam medium Eagle yang dimodifikasi Dulbecco (DMEM) yang ditambah dengan 10% serum sapi janin yang diinaktivasi panas (FBS, Gibco), 100 unit/mL penisilin, dan 100 unit/mL streptomisin (Sigma) di bawah atmosfer 5% CO 2 pada suhu 37°C. Arsip galur MRSA USA300 (ATCC BAA-1717) dan galur S. aureus yang rentan terhadap methicillin (MSSA) Newman (ATCC 25904) dipertahankan pada suhu -80°C di laboratorium kami. Galur S. aureus ditumbuhkan dalam kaldu kedelai triptikase (TSB) dan pada agar TSB pada suhu 37°C kecuali dinyatakan lain. Penghambatan pertumbuhan bakteri diperiksa dengan memantau OD 600 .
2.8 Uji Sitotoksisitas
Uji sitotoksisitas dilakukan melalui uji MTT seperti yang dijelaskan sebelumnya [ 29 ]. Secara singkat, sel L929 dikultur dalam pelat 96-sumur (5000 sel/sumur). Setelah 24 jam, sel-sel tersebut diobati dengan medium yang mengandung bahan tersebut selama 24–48 jam. Volume DMSO yang sama digunakan sebagai kontrol. Dua puluh mikroliter larutan MTT 5 mg/mL (Beyotime Bio., Beijing, Cina) ditambahkan ke setiap sumur dan diinkubasi selama 4 jam pada suhu 37°C. Akhirnya, 100 µL DMSO ditambahkan untuk melarutkan kristal formazan. Nilai OD diukur pada 490 nm menggunakan penanda enzim (Multiskan FC, Thermo Fisher). Sel-sel yang tidak diobati digunakan sebagai referensi, dengan nilai viabilitas yang dinormalisasi sebesar 100%.
Selain itu, pewarnaan kalsein-AM digunakan untuk memeriksa dampak tFNA, tFNA-mecA, dan TAC terhadap pertumbuhan dan morfologi sel L929 selama 24 dan 48 jam. Sampel diamati melalui mikroskop fluoresensi.
2.9 Uji Apoptosis Sel
Untuk mengevaluasi dampak berbagai nanomaterial pada apoptosis sel L929, sel-sel tersebut dikultur dalam DMEM yang dilengkapi dengan 10% FBS dan 1% penisilin-streptomisin pada suhu 37°C dalam atmosfer yang dilembabkan dengan 5% CO2 . Sel-sel L929 disemai ke dalam pelat 6-sumur dengan kepadatan 1 × 105 sel per sumur dan dibiarkan menempel semalaman. Keesokan harinya, medium diganti dengan DMEM baru yang mengandung berbagai konsentrasi TAC (250, 500, dan 750 nM) atau TC (750 nM). Sel-sel diinkubasi dengan perlakuan ini selama 24 jam. Setelah inkubasi, sel-sel apoptotik dideteksi melalui pewarnaan Annexin V-FITC/PI (Beyotime, Beijing, Cina) diikuti oleh analisis flow cytometry. Persentase sel apoptosis diukur dan dibandingkan di seluruh kelompok perlakuan yang berbeda untuk menilai efek nanomaterial pada apoptosis sel L929.
2.10 Studi Toksisitas Percontohan
Evaluasi toksisitas in vivo awal dilakukan pada tikus C57BL/6J. TAC (750 nM) diberikan melalui injeksi vena ekor. Sampel darah dikumpulkan melalui tusukan jantung untuk analisis kimia klinis dan hematologi. Organ utama—termasuk jantung, paru-paru, hati, limpa, dan ginjal—diambil dan difiksasi dalam formalin penyangga netral 10%. Jaringan diproses menggunakan protokol histologis standar, dikeringkan, ditanamkan dalam parafin, dan dipotong dengan ketebalan 5 µm. Potongan diwarnai dengan hematoksilin dan eosin (H&E) dan dilakukan pemeriksaan histopatologi.
2.11 Pemeriksaan Penyerapan Bakteri terhadap TAC
Penyerapan nanomaterial oleh bakteri diamati melalui mikroskopi konfokal dan flow cytometry. Untuk visualisasi, sianin-5 (Cy5) digunakan sebagai penanda pengubah. Sel MRSA USA300 (5 × 105 colony -forming unit [CFU]/mL) diinkubasi dengan 100 nM Cy5-ssDNA, Cy5-tFNA, atau Cy5-TAC dalam medium TSB selama 3 jam. Sel dikumpulkan dengan sentrifugasi dan diwarnai dengan pewarna 4′,6-diamidino-2-phenylindole (DAPI) selama 10 menit, setelah itu dicuci berulang kali dengan PBS dan disuspensikan kembali dalam PBS. Akhirnya, penyerapan bakteri diamati melalui mikroskopi konfokal (LSM 980, Carl Zeiss AG).
Untuk mengevaluasi tingkat penyerapan bakteri sebagai respons terhadap berbagai konsentrasi Cy5-TAC (250, 500, dan 750 nM), sel bakteri dipanen dengan sentrifugasi dan disuspensikan kembali dalam 500 µL PBS sebelum analisis flow cytometry melalui CytoFLEX FCM (Beckman, AS) yang canggih. Gambar dianalisis dengan perangkat lunak ZEN Blue (Carl Zeiss AG) dan ImageJ.
2.12 Uji Antibakteri
Konsentrasi hambat minimum (MIC) ditentukan melalui metode kaldu mikrodilusi menurut pedoman Clinical and Laboratory Standards Institute (CLSI). Sebanyak 1 × 105 sel MRSA USA300 diinokulasi dalam medium CAMHB yang mengandung nanomaterial yang diencerkan secara serial, dan nilai absorbansi pada 600 nm diukur setelah 18 jam inkubasi pada suhu 37°C. Nilai absorbansi campuran kultur pada OD 600 diukur setiap jam selama 24 jam dan digunakan untuk memetakan kurva pertumbuhan. Setelah perlakuan MRSA USA300 dengan 0,25 × MIC dan 0,5 × MIC TAC, kaldu bakteri diencerkan secara serial dengan medium segar dan diinokulasi dalam pelat kultur TSB padat. Bakteri diinkubasi semalaman dalam inkubator bakteri pada suhu 37°C, dan koloni dihitung keesokan harinya.
Berdasarkan penentuan MIC, konsentrasi bakterisida minimum (MBC) dievaluasi lebih lanjut. Suspensi bakteri yang diobati dengan berbagai konsentrasi obat (1/2 × MIC, 1 × MIC, 2 × MIC, 4 × MIC, 8 × MIC, dan 16 × MIC) dikumpulkan, dan 100 µL dari setiap kelompok ditaburkan ke pelat agar TSB segar dan disebarkan secara merata. Pelat kemudian diinkubasi pada suhu 37°C selama 18–24 jam. Setelah inkubasi, pertumbuhan koloni bakteri diperiksa. MBC didefinisikan sebagai konsentrasi obat terendah yang menghasilkan pengurangan ≥99,9% pada bakteri yang hidup, yang sesuai dengan tidak adanya pembentukan koloni yang terlihat pada pelat agar.
2.13 RT-qPCR Kuantitatif
MRSA USA300 dikumpulkan dari setiap kelompok dengan sentrifugasi, setelah itu total RNA bakteri diisolasi dengan kit ekstraksi RNA (TianGen, Cina). Kualitas dan konsentrasi total RNA ditentukan melalui elektroforesis gel agarosa dan spektrofotometri UV. cDNA dibuat dengan PrimeScript RT Reagent Kit (Cat# RR047Q, TaKaRa). qPCR dilakukan dengan menggunakan FastStart Universal SYBR Green Master Mix (Roche) dan instrumen CFX96 (Bio-Rad). Kuantifikasi relatif produk transkripsi dihitung dari rasio ekspresi gen target relatif terhadap 16S rRNA (housekeeping genes). Primer yang digunakan untuk qPCR tercantum dalam Tabel S1 .
2.14 Analisis Western Blot
Bakteri dalam fase stabil dipanen dan dilarutkan kembali dalam PBS, diikuti dengan penambahan inhibitor protease ke dalam larutan suspensi. Campuran tersebut kemudian diinkubasi selama minimal 30 menit pada suhu 37°C. Bakteri tersebut kemudian mengalami sonikasi dan sentrifugasi pada 13.000 rpm selama 30 menit pada suhu 4°C. Supernatan bakteri dikumpulkan dengan ultracentrifugasi pada suhu 4°C selama 2 jam untuk mengumpulkan protein membran dari total protein. Akhirnya, pelet protein membran disuspensikan kembali dalam PBS, dan konsentrasi sampel ditentukan melalui metode kuantifikasi protein Bradford. Sampel dipisahkan dengan SDS‒PAGE, dan kemudian protein dipindahkan dari gel ke membran PVDF dan diblokir dengan bubuk susu skim 5%. Pengenceran 1:2000 antibodi anti-PBP2a tikus dan pengenceran 1:10.000 antibodi IgG anti-tikus kambing digunakan untuk mendeteksi protein PBP2a. Sampel dideteksi melalui sistem pencitraan Bio-Rad, dan nilai skala abu-abu pita diukur melalui ImageJ Pro Plus.
2.15 Evaluasi Efek Antibakteri Melalui Scanning Electron Microscopy (SEM) dan Transmission Electron Microscopy (TEM)
Untuk mengevaluasi efek antibakteri dari perawatan, kami menggunakan SEM dan TEM untuk mengamati S. aureus di berbagai kelompok eksperimen: kelompok kontrol yang tidak diobati, ssDNA-cef, TC, dan TAC. Kelompok kontrol yang tidak diobati berfungsi sebagai dasar untuk morfologi bakteri alami. MRSA USA300 dikultur semalam, diencerkan (1:100) dalam 20 mL media TSB, dan diinkubasi pada suhu 30°C dengan pengocokan hingga OD 600 mencapai 0,3. Pada titik ini, ssDNA-cef, TC, dan TAC ditambahkan ke masing-masing kelompok. Setelah inkubasi selama 3 jam, sampel bakteri dari setiap kelompok dikumpulkan, dicuci dalam PBS, dan disuspensikan kembali dalam 4% (v/v) glutaraldehida semalam untuk fiksasi. Sampel yang telah difiksasi kemudian didehidrasi, dilapisi, dan disiapkan untuk analisis SEM (Zeiss AG, EVO-18, Jerman) untuk memvisualisasikan perubahan morfologi permukaan dan mengukur keberadaan S. aureus . Analisis TEM (JSM-7900F, Jepang) kemudian dilakukan untuk mengamati perubahan ultrastruktur, termasuk potensi gangguan dinding sel dan kerusakan intraseluler.
2.16 Konsentrasi Penghambatan Biofilm Minimum (MBIC) dan Konsentrasi Pemberantasan Biofilm Minimum (MBEC)
Penentuan MBIC dilakukan menggunakan pelat 96-sumur yang dilapisi terlebih dahulu dengan plasma kelinci beku-kering. Kultur S. aureus yang tumbuh selama 12 jam diencerkan 1:100 dalam medium BHI yang ditambah dengan 3% NaCl dan 0,5% glukosa. Pada pelat yang disiapkan, setiap sumur menerima 197 µL suspensi bakteri yang diencerkan dan 2,56 µL larutan stok TAC, dengan konsentrasi awal maksimum berkisar dari 0 hingga 4 × MIC. TAC diencerkan secara serial di seluruh sumur. Sumur yang hanya berisi suspensi bakteri berfungsi sebagai kontrol yang tidak diobati. Pelat diinkubasi pada suhu 37°C selama 24 jam. Setelah inkubasi, sumur diwarnai dengan 1% kristal violet pada suhu kamar dan dihilangkan pewarnaannya dengan 33% asam asetat glasial pada suhu 37°C selama sekitar 30 menit. Absorbansi pada 570 nm direkam menggunakan pembaca mikroplat multifungsi, dan pembentukan biofilm dinilai secara visual.
Untuk penentuan MBEC, biofilm pertama kali dibuat dengan membudidayakan suspensi bakteri dalam pelat 96-sumur selama 24 jam menggunakan metode yang dijelaskan di atas. Setelah inkubasi, medium dikeluarkan dengan hati-hati, dan larutan antimikroba baru ditambahkan ke setiap sumur pada konsentrasi berkisar dari 0 hingga 16 × MIC TAC. Sumur tanpa perawatan antimikroba berfungsi sebagai kontrol negatif. Pelat diinkubasi pada suhu 37°C selama 24 jam tambahan. Setelah perawatan, medium dibuang, dan sumur dicuci dengan lembut dengan PBS untuk menghilangkan bakteri planktonik. Tidak adanya biofilm yang terlihat dianggap sebagai indikasi MBEC. Selain itu, sumur diwarnai dengan 1% kristal violet pada suhu kamar dan dihilangkan pewarnaannya dengan 33% asam asetat glasial pada suhu 37°C selama sekitar 30 menit. Absorbansi pada 570 nm dicatat, dan keberadaan atau pemberantasan biofilm selanjutnya didokumentasikan secara visual.
2.17 Infeksi Sistemik yang Diinduksi MRSA pada Galleria mellonella
Uji kelangsungan hidup in vivo dilakukan menggunakan larva G. mellonella yang dipelihara di laboratorium kami pada suhu 25°C dengan diet buatan berupa madu dan berbagai tepung. Kelompok yang terdiri dari 10 larva instar akhir, masing-masing berbobot sekitar 300 mg, digunakan untuk semua pengujian. Suntikan 10 µL diberikan ke dalam hemocoel proleg kanan terakhir melalui spuit Hamilton. Perlakuan meliputi natrium seftriakson, TC, atau TAC. Kelompok kontrol terdiri dari larva yang tidak menerima suntikan dan yang disuntik dengan pembawa (PBS dengan 2% DMSO). Untuk model infeksi, larva disuntik dengan 10 µL suspensi S. aureus USA300 dalam larutan garam (5 × 106 CFU /larva). Setelah inkubasi selama 30 menit pada suhu 37°C, larva menerima suntikan 10 µL Cef, TC, atau TAC (1 µM, 10 µL) ke proleg kiri terakhir. Semua larva kemudian diinkubasi pada suhu 37°C dalam cawan petri steril. Kelompok kontrol meliputi larva yang tidak diobati dan yang disuntik dengan larutan pembawa (PBS dengan 2% DMSO). Untuk memantau hasil infeksi, larva diobservasi setiap hari untuk kelangsungan hidup selama periode 5 hari pascaperawatan. Larva dianggap mati jika gagal merespons sentuhan dan diberi skor sesuai dengan kondisinya. Selain itu, sekumpulan larva lainnya mengalami protokol perawatan yang sama. Segera setelah perawatan (0 jam) dan sekali lagi pada 48 jam, larva dibius, dan permukaannya didisinfeksi dengan etanol. Setiap larva ditempatkan ke dalam tabung Eppendorf terpisah yang berisi 1 mL PBS steril. Larva dihomogenkan dengan alu bersih, dicuci dengan etanol, dan dibakar di antara penggunaan. Homogenat tersebut mengalami pengenceran serial dan ditaburkan ke media Tryptic Soy Agar [ 30 ]. CFU dihitung setelah setidaknya 48 jam inkubasi pada suhu 37°C untuk menentukan jumlah bakteri.
2.18 Percobaan Model Pneumonia
Semua percobaan pada hewan dilakukan dengan mematuhi pedoman Komite Perlindungan dan Penggunaan Hewan di Universitas Pengobatan Cina Changchun. Tikus betina C57BL/6J berumur delapan minggu dengan berat sekitar 20 g digunakan. Model tikus pneumonia akut yang disebabkan oleh S. aureus dibuat seperti yang dijelaskan sebelumnya [ 31 ].
Singkatnya, tikus dibius dan kemudian diinokulasi dengan suspensi S. aureus untuk menginfeksi jaringan paru-paru melalui jalur hidung. Jumlah bakteri yang diberikan ditentukan menurut metode sebelumnya [ 32 , 33 ]. Untuk menilai kelangsungan hidup, setiap kelompok yang terdiri dari 10 tikus diinfeksi dengan 2 × 108 CFU /30 µL S. aureus . Pada 1 jam pascainokulasi dengan 2 × 108 CFU /30 µL S. aureus , tikus diberikan Cef, TC, atau TAC (10 µM, 100 µL) secara intravena melalui vena ekor. Perawatan ini diulang setiap 12 jam. Setelah 72 jam, tingkat kelangsungan hidup dievaluasi.
Untuk pemeriksaan histopatologi dan penentuan jumlah bakteri, setelah inokulasi S. aureus (1 × 108 CFU /30 µL) dan pemberian obat berikutnya seperti dijelaskan di atas, tikus disuntik mati pada 48 jam pascainokulasi. Jaringan paru-paru dipotong secara aseptik; paru-paru kiri kemudian dihomogenkan, dan CFU dihitung jumlahnya.
2.19 Analisis Flow Cytometry untuk Pneumonia
Kelompok tikus tambahan ( n = 10 per kelompok) diinfeksi intranasal dengan 2 × 108 CFU /30 µL S. aureus . Satu jam pasca infeksi, tikus menerima pemberian intravena Cef, TC, atau TAC (10 µM, 100 µL) melalui vena ekor, yang diulang pada interval 12 jam. Paru-paru dipanen dan dibilas dengan garam yang didinginkan terlebih dahulu dalam cawan kultur sel, dan pembuluh darah besar dan jaringan ikat dipotong melalui gunting. Jaringan paru-paru dicincang halus, dicerna dengan tripsin, dan pencernaan dihentikan dengan medium 1640. Jaringan kemudian disaring untuk mendapatkan suspensi sel, dengan hati-hati menjaga tekanan yang merata selama penyaringan.
Suspensi sel dilewatkan melalui saringan 70 µm yang ditempatkan pada tabung sentrifus 50 mL. PBS yang didinginkan terlebih dahulu ditambahkan tetes demi tetes, dan pendorong jarum suntik 5 mL digunakan untuk menggiling jaringan dengan lembut hingga tidak ada potongan jaringan yang terlihat, hanya menyisakan jaringan ikat halus pada saringan. Suspensi sel selanjutnya disentrifugasi pada 300 × g selama 5 menit pada suhu 4 °C. Supernatan dibuang, dan pelet sel disuspensikan kembali dalam 2 mL buffer lisis eritrosit. Setelah inkubasi 5–8 menit pada suhu kamar dengan vortexing, 2 mL PBS yang didinginkan terlebih dahulu ditambahkan, dan suspensi disentrifugasi lagi pada 300 × g selama 5 menit pada suhu 4 °C. Supernatan dibuang, dan langkah pencucian diulang. Pelet sel akhir disuspensikan kembali dalam 1 mL PBS yang didinginkan terlebih dahulu.
Alikuot 10 µL diambil untuk penghitungan sel. Untuk flow cytometry, 1 × 106 sel per sampel diresuspensi dalam 1 mL PBS yang telah didinginkan terlebih dahulu, disentrifugasi pada 350 × g selama 5 menit pada suhu 4°C, dan dilindungi dari cahaya. Setelah supernatan dibuang, sel diinkubasi dengan PBS yang mengandung 2,5% BSA di atas es selama 10 menit. Setelah inkubasi, sel diberi label dengan antibodi CD11b anti-tikus/manusia terkonjugasi PE dan antibodi Ly6G anti-tikus terkonjugasi FITC (keduanya dari Elabscience, Tiongkok). Sampel diinkubasi pada suhu 4°C selama 30 menit dalam gelap. Sel dicuci dengan buffer, diresuspensi, dan dianalisis dengan flow cytometry.
2.20 Analisis Statistik
Kecuali dinyatakan lain dalam keterangan gambar, setiap percobaan diulang tiga kali atau lebih. Perbedaan antar kelompok dianalisis dengan ANOVA atau uji t Student , dan kelangsungan hidup hewan (kurva kelangsungan hidup Kaplan‒Meier) ditentukan dengan uji log-rank . Semua hasil kuantitatif disajikan sebagai rata-rata ± simpangan baku. Analisis data dilakukan melalui SPSS 21.0 (IBM, Armonk, NY), dan signifikansi statistik ditetapkan sebagai p < 0,05.
3 Hasil dan Pembahasan
3.1 Identifikasi TAC yang Berhasil Disintesis
Untuk mensintesis TAC, kami awalnya merekayasa nanostruktur tetrahedral yang mengandung ASO, disebut sebagai TA. ASO secara langsung mengikat target mRNA untuk memblokir translasi atau merekrut RNase H untuk degradasi, menawarkan efek pembungkaman yang lebih langsung dan dapat diprediksi dalam sistem bakteri dibandingkan dengan jalur siRNA multistep yang bergantung pada RISC [ 34 , 35 ]. TA ini tersusun dari lima ssDNA yang merakit diri melalui pasangan basa komplementer untuk membentuk konfigurasi tetrahedral. Selanjutnya, Cef ditambahkan, dan campuran diinkubasi selama 1 hari untuk menghasilkan TAC (Gambar 1A ). Lebih jauh lagi, ASO dapat dimodifikasi secara kimia untuk meningkatkan resistensi nuklease dan afinitas target, dan mereka menunjukkan distribusi intraseluler yang lebih luas, memungkinkan akses ke transkrip sitoplasma dan nuklir. Imunogenisitasnya yang lebih rendah dan keberhasilan klinis yang terbukti dalam terapi yang disetujui FDA juga mendukung kesesuaiannya untuk aplikasi anti-infeksi sistemik [ 36 , 37 ]. Secara paralel, kami menyiapkan nanostruktur tetrahedral menggunakan empat ssDNA tanpa ASO, disebut sebagai tFNA. tFNA selanjutnya dimuat dengan Cef untuk membentuk komposit TC (Gambar S1A ). PAGE (8%) digunakan untuk mendeteksi TAC pada berbagai tahap sintesis, yang mengungkapkan bahwa berat molekul TAC sesuai dengan harapan kami, dengan demikian secara awal menunjukkan keberhasilan sintesis TAC (Gambar 1B ). Untuk menunjukkan bahwa Cef dapat berhasil dimuat ke dalam TA, kami mengukur spektrum serapan UV dari TA, Cef, dan TAC, dan puncak serapan TA berada pada 260 nm, yang mirip dengan nilai tipikalnya. Puncak serapan TAC mendekati puncak serapan TA (260 nm) dan Cef (242 nm), yang menunjukkan bahwa Cef berhasil dimuat ke dalam TA (Gambar 1C ).
GAMBAR 1
Buka di penampil gambar
Kekuatan Gambar
Karakterisasi TAC. (A) Jalur sintesis TC dan TAC. (B) Sintesis TAC yang berhasil dikonfirmasi oleh elektroforesis gel poliakrilamid (PAGE), yang menunjukkan ukuran relatif DNA untai tunggal, perakitan parsial, dan TAC. Jalur 5: S2; Jalur 4: S2 + S3; Jalur 3: S2 + S3 + S4; Jalur 2: TC; Jalur 1: TAC. (C) Hasil spektrum serapan ultraviolet menunjukkan Cef dimuat ke TA. (D) Gambar mikroskopi gaya atom TAC. (E dan F) Kurva standar Cef dan efisiensi pemuatan tFNA 100 nM dan peningkatan konsentrasi ampisilin secara bertahap pada TC untuk menghitung laju pemuatan obat. (G) Uji pelepasan in vitro Cef dan TAC dalam PBS. (H dan I) Karakterisasi potensi zeta dan ukuran TC dan TAC.
Selain itu, tFNA menunjukkan laju pemuatan obat yang tinggi pada konsentrasi 100 nM [ 6 ]. Oleh karena itu, kami menentukan laju pemuatan obat dari tFNA 100 nM dan TC di berbagai konsentrasi Cef. Konsentrasi pemuatan obat yang optimal ditentukan berdasarkan kurva standar obat Cef dan hasil percobaan pemuatan obat, yang mengungkapkan bahwa laju pemuatan obat meningkat dengan meningkatnya konsentrasi obat tetapi stabil ketika konsentrasi melebihi 500 µg/mL (Gambar 1E,F dan Gambar S1 ). Dalam percobaan pelepasan obat berikutnya, hasilnya menunjukkan pelepasan TAC yang lambat dan baik. Gambar 1G menunjukkan profil pelepasan dalam PBS. Cef sendiri dilepaskan dengan cepat dalam PBS melalui dialisis. Namun, pelepasan Cef dari TAC dicirikan oleh pola pelepasan bertahap, dengan efisiensi pelepasan 66,3% setelah 24 jam dan pelepasan kumulatif 69,3% pada 48 jam. Khususnya, Cef dari TAC menunjukkan pola pelepasan yang lebih lambat. Kinetika pelepasan menunjukkan pelepasan sebesar 39% pada 4 jam dan pelepasan sebesar 64,7% pada 24 jam. Sementara itu, kami menilai pelepasan Cef dari TAC dalam S. aureus , mengamati pelepasan kumulatif sebesar 59,7% setelah 48 jam. Pola pelepasan berkelanjutan ini berkontribusi pada pemanfaatan penuh Cef (Gambar S1F ).
Selanjutnya, AFM mengonfirmasi dimensi TAC (Gambar 1D ). Lebih jauh, analisis DLS mengungkap perubahan signifikan dalam potensi zeta dan ukuran TAC relatif terhadap TA. Setelah penambahan ceftriaxone, TAC yang disintesis menunjukkan sedikit peningkatan ukuran dibandingkan dengan TC, yang konsisten dengan harapan kami. Secara khusus, potensi zeta dan ukuran partikel TA masing-masing adalah -4,62 ± 0,46 mV dan 15,76 ± 0,51 nm, sedangkan TAC masing-masing adalah -14,37 ± 0,71 mV dan 33,31 ± 1,10 nm (Gambar 1H,I ). Demikian pula, tFNA dirakit dari empat untai oligonukleotida dan kemudian dimuat dengan ceftriaxone untuk memperoleh TC, seperti yang ditunjukkan pada Gambar S1 .
Temuan ini menunjukkan bahwa ASO mecA dan Cef berhasil dimuat ke tFNA. Selain itu, kami menilai stabilitas tFNA 100 nM dan TAC dalam 10% FBS, lisat sel A549, dan lisat MRSA. tFNA terdegradasi setelah 4–6 jam, sedangkan TAC menunjukkan stabilitas yang lebih baik, dengan pita yang sesuai dengan TAC menunjukkan intensitas yang berkurang bahkan setelah 12 jam inkubasi (Gambar S2 ). Hasil ini mengonfirmasi keberhasilan sintesis TAC dan stabilitasnya yang unggul.
3.2 Penentuan Aktivitas Antibakteri In Vitro
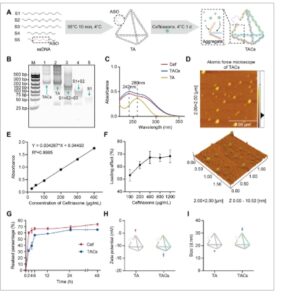
TAC mengerahkan efek anti-MRSA mereka melalui pelepasan ceftriaxone dan TA (Gambar 2A ). Untuk menilai lebih lanjut kemanjuran anti-MRSA mereka, kami awalnya menentukan aktivitas antibakteri TAC terhadap S. aureus USA300. Seperti yang ditunjukkan pada Gambar 2B , MIC dari Cef, TC, dan TAC terhadap MRSA USA300 masing-masing adalah 256, 128, dan 16 µg/mL. Baik TC maupun TAC secara signifikan mengurangi MIC Cef terhadap MRSA USA300, dengan TAC mengurangi MIC sekitar 10 kali lipat. Temuan ini menunjukkan bahwa pemuatan nanosistem ASO yang menargetkan penghambatan mecA secara signifikan meningkatkan sensitivitas MRSA USA300 terhadap Cef.
GAMBAR 2
Buka di penampil gambar
Kekuatan Gambar
Aktivitas antibakteri TAC terhadap MRSA. (A) Mekanisme kerja TAC melibatkan pelepasan TA dan ceftriaxone. (B) Konsentrasi hambat minimum (MIC) ceftriaxone, TC, dan TAC terhadap MRSA USA300. (C) Kurva pertumbuhan MRSA selama periode 16 jam setelah paparan terhadap TA, ceftriaxone (Cef), TC, atau TAC. (D) Analisis komparatif efek antibakteri ceftriaxone, TC, dan TAC pada 1 × MIC Cef , 0,5 × MIC Cef , dan 0,25 × MIC Cef , sebagaimana ditentukan oleh nilai OD 600 . (E dan F) Perbandingan jumlah koloni lempeng MRSA dalam kelompok ceftriaxone, TC, dan TAC pada 0,25 × MIC Cef , 0,5 × MIC Cef , dan 1 × MIC Cef . (G dan H) Penilaian MBC Cef, TC, dan TAC terhadap MRSA. Analisis statistik: ns menunjukkan tidak ada perbedaan signifikan ( p > 0,05), * p < 0,05, ** p < 0,01, *** p < 0,001. ND: tidak terdeteksi.
Berikutnya, kami mengukur nilai absorbansi pada OD 600 setelah mengkulturkan tFNA dengan MRSA USA300 selama 24 jam pada berbagai konsentrasi. Hasilnya menunjukkan bahwa tFNA pada konsentrasi kurang dari 400 nM tidak memengaruhi pertumbuhan MRSA USA300, sedangkan konsentrasi 400 nM menghambat pertumbuhan MRSA USA300 (Gambar S3A ). Untuk lebih lanjut menentukan apakah tFNA memengaruhi pertumbuhan S. aureus , kami memperlakukan S. aureus MSSA Newman dan isolat klinis SA1B3G (Rumah Sakit Afiliasi Universitas Pengobatan Tradisional Cina Liaoning, MSSA) melalui metode yang sama. Kami menemukan bahwa tFNA pada konsentrasi kurang dari 300 nM memiliki efek minimal pada pertumbuhan S. aureus (Gambar S3B,C ). Selain itu, kami menguji efek anti-MRSA dari ssDNA-Cef pada USA300. Nilai MIC, pengukuran OD, dan jumlah koloni menunjukkan bahwa tidak ada perbedaan signifikan dalam efek antibakteri antara ssDNA-Cef dan Cef (Gambar S4 ).
Kurva pertumbuhan yang diperoleh dengan mengobati MRSA USA300 dengan antibiotik pada MIC Cef 0,5 kali lipat (128 µg/mL) selama 16 jam mengungkapkan bahwa TAC memiliki efek yang secara signifikan lebih besar pada MRSA USA300 daripada pengobatan lainnya (Gambar 2C ). Pada konsentrasi yang sama, dibandingkan dengan Cef saja, TAC sangat menghambat pertumbuhan MRSA USA300. Untuk menyelidiki kemungkinan ini lebih lanjut, kami mengobati MRSA USA300 dengan dosis Cef, TC, dan TAC yang lebih rendah dan menemukan bahwa TAC menunjukkan efek bakterisida bahkan pada MIC 0,25 kali lipat (Gambar 2D ). Jumlah koloni CFU juga dengan jelas mencerminkan hasil ini (Gambar 2E,F ). Pengujian MBC mengungkapkan bahwa TAC mencapai aktivitas bakterisida lengkap terhadap MRSA pada konsentrasi 4 × MIC, sebagaimana dibuktikan dengan tidak adanya koloni yang terlihat pada pelat agar, yang memenuhi kriteria untuk kemanjuran bakterisida (≥99,9% membunuh). Sebaliknya, efek bakterisida serupa diamati untuk kelompok Cef dan TC hanya pada 16 × MIC. Temuan ini menunjukkan bahwa TAC menunjukkan potensi bakterisida yang unggul dengan efek yang bergantung pada konsentrasi yang jelas (Gambar 2G,H ).
3.3 Mekanisme Kerja TAC Terhadap MRSA
Mengingat bahwa fungsionalitas TAC bergantung pada kemampuannya untuk mengikat atau mengakses bakteri, kami menilai penyerapan tFNA dan TAC oleh bakteri melalui mikroskopi pemindaian laser confocal (CLSM) dan flow cytometry. Gambar 3A menunjukkan gambar confocal MRSA USA300 setelah inkubasi 3 jam dengan Cy5-ssDNA, Cy5-tFNA, dan Cy5-TAC. Bakteri diwarnai dengan DAPI fluoresensi biru, sedangkan TAC ditandai dengan Cy5 fluoresensi merah. Fluoresensi ungu pada gambar gabungan menunjukkan bahwa Cy5-tFNA dan Cy5-TAC diserap secara efisien oleh bakteri. Sebaliknya, fluoresensi merah Cy5-ssDNA hampir tidak teramati setelah 3 jam, kemungkinan karena ketidakstabilan atau degradasi ssDNA di dalam bakteri. Untuk mengevaluasi lebih lanjut efisiensi penyerapan bakteri pada tFNA dan TAC, kami menggunakan flow cytometry untuk menganalisis kemampuan MRSA USA300 untuk mengambil berbagai konsentrasi TAC. Hasil yang ditunjukkan pada Gambar 3B,C dan Gambar S5 menunjukkan bahwa penyerapan TAC oleh bakteri meningkat dengan meningkatnya konsentrasi. Hasil ini menunjukkan bahwa tFNA dan TAC dapat secara efektif diambil oleh bakteri dan menunjukkan stabilitas struktural yang baik. Peningkatan penyerapan ini dapat dikaitkan dengan perubahan konformasi yang diinduksi ASO dan modulasi permukaan yang dimediasi ceftriaxone. Secara khusus, integrasi ASO kemungkinan meningkatkan muatan permukaan negatif dan kekakuan struktural nanostruktur, yang mendorong interaksi elektrostatik dengan membran bakteri [ 38 , 39 ]. Sementara itu, meskipun Cef sendiri tidak secara langsung memfasilitasi penyerapan, penggabungannya dapat memodulasi muatan permukaan dan hidrofilisitas, sehingga secara tidak langsung meningkatkan asosiasi bakteri [ 40 ].

GAMBAR 3
Buka di penampil gambar
Kekuatan Gambar
TAC secara efektif mengurangi resistensi obat MRSA. (A) Gambar mikroskopi pemindaian laser konfokal yang menunjukkan bahwa MRSA mampu menginternalisasi tFNA dan TAC. Fluoresensi biru menyorot jumlah total bakteri hidup, sedangkan fluoresensi merah berhubungan dengan keberadaan DNA untai tunggal berlabel Cy5 (ssDNA), tFNA, atau TAC. Gambar yang digabungkan menunjukkan fluoresensi ungu, yang menunjukkan kolokalisasi di antara ssDNA berlabel Cy5, tFNA, atau TAC dan bakteri. (B) Analisis kuantitatif tingkat penyerapan ssDNA, tFNA, dan TAC dengan mikroskopi pemindaian laser konfokal. (C) RT-qPCR dilakukan untuk menganalisis ekspresi gen PBP2a sebagai respons terhadap paparan seftriakson dan TAC (0,5 × MIC Cef ) selama 24 jam. MRSA USA300 tanpa pengobatan digunakan sebagai kelompok kontrol. (D) Tingkat ekspresi PBP2a diukur dengan western blotting dengan adanya ssDNA-Cef, TC, TAC (0,5 × MIC Cef ), dan TA. (E) Gambar TEM diperoleh dari bakteri yang diobati dengan ssDNA-Cef, TC, dan TAC selama 3 jam. Kelompok kontrol adalah MRSA USA300, yang tidak menerima pengobatan. (F) TAC memberikan efek antibakterinya melalui pelepasan TA dan ceftriaxone. TA menargetkan mecA , mengurangi ekspresi PBP2a, sedangkan ceftriaxone mengganggu dinding sel MRSA. Tindakan ini bekerja secara sinergis untuk memerangi MRSA. (G) Gambar SEM diperoleh dari biofilm yang diobati dengan ssDNA-Cef, TC, dan TAC. (H) Konsentrasi penghambatan biofilm minimum (MBIC) TAC terhadap biofilm S. aureus dinilai dengan pewarnaan kristal violet. (I dan J) Konsentrasi pemberantasan biofilm minimum (MBEC) TAC ditentukan dengan pewarnaan kristal violet setelah perawatan biofilm yang telah terbentuk sebelumnya. Analisis statistik: ns menunjukkan tidak ada perbedaan signifikan ( p > 0,05), * p < 0,05, ** p < 0,01, dan *** p < 0,001.
Gen mecA yang mengkode protein PBP2a memiliki afinitas yang sangat rendah untuk sebagian besar antibiotik β-laktam [ 41 ]; oleh karena itu, bahkan dengan adanya antibiotik, MRSA USA300 masih mampu mensintesis dinding sel dan menghindari pembunuhan antibiotik [ 42 ]. Kami memeriksa tingkat transkrip gen mecA di MRSA USA300 melalui RT-qPCR. tFNA sendiri hampir tidak memiliki efek pada transkripsi mecA , bahkan pada konsentrasi hingga 300 nM (Gambar S6A ). Namun, setelah penambahan Cef, tingkat transkrip mecA meningkat daripada menurun, terutama TC, yang meningkatkan ekspresi mecA lebih dari dua kali lipat, mungkin karena stimulasi terbalik ekspresi mecA dengan adanya antibiotik. Tingkat transkrip mecA menurun dengan meningkatnya konsentrasi TC dan TAC, yang menunjukkan bahwa TC dan TAC mampu menghambat ekspresi mecA dalam cara yang bergantung dosis (Gambar 3C dan Gambar S6B ). Bahasa Indonesia: Untuk memverifikasi lebih lanjut apakah TAC memiliki efek regulasi pada protein PBP2a dengan immunoblotting, kami mengekstrak protein membran PBP2a dari MRSA USA300. Hasil ini konsisten dengan hasil qPCR, dan TAC secara efektif menghambat ekspresi PBP2a dalam MRSA USA300, yang memungkinkan Cef untuk secara efektif mengerahkan efek pembunuhannya (Gambar 3D ). Berikutnya, kami menggunakan SEM untuk mengamati jumlah bakteri pada setiap kelompok perlakuan. Pada kelompok TAC, ada pengurangan yang signifikan dalam jumlah bakteri. Menggunakan TEM, kami juga mengamati kerusakan dinding sel MRSA USA300 setelah perlakuan dengan TAC (Gambar 3E ). TAC diambil oleh MRSA dan melepaskan TA dan ceftriaxone. Dalam penelitian ini, ASO dirancang untuk secara spesifik berhibridisasi dengan mRNA mecA , sehingga menghambat translasi PBP2a. Penekanan ekspresi mecA mengembalikan fungsi protein pengikat penisilin yang menjadi target antibiotik β-laktam, yang memungkinkan natrium seftriakson untuk memberikan efek antibakterinya melalui penghambatan ikatan silang peptidoglikan (Gambar 3F ). Singkatnya, temuan kami menunjukkan aktivitas antibakteri TAC yang kuat, yang menyoroti potensinya sebagai strategi terapi yang menjanjikan terhadap infeksi bakteri yang resistan terhadap antibiotik.
S. aureus secara signifikan meningkatkan resistensi antibiotiknya melalui pembentukan biofilm, suatu mekanisme relevansi klinis yang kritis. SEM mengungkapkan bahwa kelompok kontrol menunjukkan struktur biofilm yang melimpah, padat, dan berlapis-lapis, dengan sel-sel bakteri tertanam jelas dalam matriks ekstraseluler. Sebaliknya, pengobatan dengan TAC secara nyata mengurangi pembentukan biofilm, menghasilkan arsitektur yang lebih tipis dan lebih terganggu (Gambar 3G ). Pewarnaan kristal violet selanjutnya menegaskan bahwa MBIC TAC terhadap S. aureus setara dengan MIC TAC (16 µg/mL) (Gambar 3H ). Setelah 24 jam pengobatan TAC setelah pembentukan biofilm, MBEC—didefinisikan sebagai konsentrasi terendah di mana tidak ada biofilm yang terlihat dapat diamati—ditetapkan sebesar 16 × MIC (256 µg/mL) (Gambar 3I,J ). Khususnya, MBEC TAC secara signifikan lebih tinggi daripada MBC-nya terhadap bakteri planktonik dan 16 kali lipat lebih tinggi daripada MBIC. Ambang batas yang tinggi ini mencerminkan peningkatan toleransi populasi bakteri yang tidak aktif yang tertanam dalam matriks biofilm pelindung. Yang penting, TAC menunjukkan aktivitas yang kuat dalam menghancurkan biofilm, menembus dan menghancurkan biofilm yang terbentuk secara efektif, dan selanjutnya menghambat dan menghilangkan bakteri yang tidak aktif, sehingga berkontribusi pada pemberantasan biofilm secara menyeluruh.
3.4 Profil Keamanan TAC
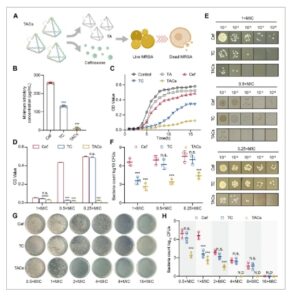
Bahasa Indonesia: Untuk memastikan keamanan dan nontoksisitas TAC untuk aplikasi potensial pada organisme hidup, kami mengevaluasi sitotoksisitasnya terhadap sel L929, serta efeknya pada pertumbuhan sel, morfologi, dan apoptosis. Seperti yang ditunjukkan pada Gambar 4A , berbagai konsentrasi TAC tidak menunjukkan sitotoksisitas yang signifikan setelah 24 atau 48 jam kokultur dengan sel L929, bahkan pada konsentrasi setinggi 750 nM. Selain itu, kami menilai dampak TAC 750 nM pada morfologi sel L929. Pewarnaan imunofluoresensi mengungkapkan bahwa sel L929 yang terpapar nanomaterial ini mempertahankan morfologi normalnya dan menunjukkan pola proliferasi yang khas (Gambar 4B ). Uji apoptosis selanjutnya mengonfirmasi bahwa tFNA 750 nM dan TAC (pada konsentrasi berkisar dari 250 hingga 750 nM) tidak menginduksi apoptosis pada sel L929 setelah 24 atau 48 jam (Gambar 4C,D ). Bersama-sama, hasil ini mengonfirmasi profil keamanan TAC yang baik. Untuk memvalidasi biokompatibilitas nanosistem yang sangat efisien dan tepat ini dan mendukung potensinya untuk penerapan klinis, serangkaian studi toksisitas in vivo dilakukan. TAC diberikan secara intravena pada konsentrasi 750 nM. Analisis histologis organ-organ utama—termasuk jantung, hati, limpa, paru-paru, dan ginjal—tidak menunjukkan tanda-tanda kerusakan jaringan atau peradangan (Gambar 4G ). Secara konsisten, penanda fungsi hati dan ginjal (ALT, AST, BUN, dan CREA) tetap dalam kisaran normal selama periode pengobatan (Gambar 4E ), dan parameter hematologi tidak menunjukkan kelainan yang signifikan (Gambar 4F ). Karena biokompatibilitas merupakan prasyarat mendasar untuk aplikasi klinis, hasil-hasil ini secara kolektif menunjukkan profil keamanan TAC yang sangat baik dan menyoroti janji strategi ini untuk pengembangan translasi di masa mendatang.
GAMBAR 4
Buka di penampil gambar
Kekuatan Gambar
Evaluasi keamanan TAC. (A) Proliferasi sel L929 dianalisis menggunakan uji MTT setelah kokultur dengan TAC selama 24 dan 48 jam. (B) Perubahan morfologi pada sel L929 diamati setelah paparan TAC. (C dan D) Efek dari berbagai konsentrasi TAC pada apoptosis sel L929 diperiksa (C) pada 24 jam dan (D) pada 48 jam. Sel apoptosis dideteksi melalui pewarnaan Annexin V-FITC/PI diikuti dengan analisis flow cytometry. (E) Biokimia darah pada hati dan ginjal. (F) Investigasi pemeriksaan hematologi. (G) Studi toksikologi dilakukan melalui analisis histologis dengan melakukan pewarnaan H&E pada irisan parafin organ utama tikus, dan hampir tidak ditemukan area yang sakit. Analisis statistik: ns menunjukkan tidak ada perbedaan signifikan (p > 0,05). ALT, alanin transaminase; AST, aspartat transaminase; BUN, nitrogen urea darah; CREA, kreatinin; Hb, hemoglobin; PLT, trombosit darah; RBC, sel darah merah; WBC, sel darah putih.
3,5 TAC Melindungi G. mellonella dari Infeksi MRSA
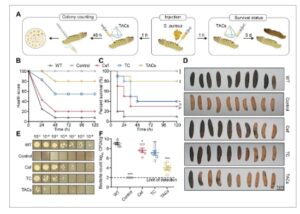
Mengingat bahwa G. mellonella memiliki sistem imun yang sangat mirip dengan vertebrata, ia merupakan model yang sangat baik untuk memvalidasi kemanjuran obat [ 30 ]. Kami mengevaluasi efek terapeutik berbagai obat dengan memantau aktivitas larva, pembentukan kokon, melanisasi, dan status kelangsungan hidup. Pengamatan kelangsungan hidup selama lima hari dilakukan setelah penyuntikan larva G. mellonella dengan inokulum bakteri dan pemberian obat uji berikutnya (Gambar 5A ). Penilaian harian kondisi larva dilakukan berdasarkan aktivitas, pembentukan kokon, melanisasi, dan kelangsungan hidup, dan kriteria penilaian terperinci disediakan dalam Tabel S3 . Menurut kriteria ini, kami menemukan bahwa skor keseluruhan untuk TAC secara signifikan lebih baik daripada skor untuk Cef atau TC (Gambar 5B ). Tingkat kelangsungan hidup untuk berbagai kelompok G. mellonella diamati, dan tingkat kelangsungan hidup kelompok WT adalah 10%. Persentase ini meningkat menjadi 30% dengan pengobatan Cef, 40% dengan pengobatan TC, dan hingga 80% dengan pengobatan TAC (Gambar 5C,D ). Percobaan beban bakteri menunjukkan bahwa TAC secara signifikan mengurangi jumlah bakteri dalam larva, dengan CFU menurun dari 8,97 menjadi 4,26 (Gambar 5E,F ). Temuan ini menyoroti potensi TAC sebagai pengobatan yang sangat efektif terhadap infeksi S. aureus .
GAMBAR 5
Buka di penampil gambar
Kekuatan Gambar
TAC mengurangi efek patogenik S. aureus pada Galleria mellonella . (A) Representasi skematis model infeksi menggunakan S. aureus USA300 dan rejimen pengobatan yang melibatkan ceftriaxone, TC, dan TAC pada G. mellonella . (B) Skor kesehatan G. mellonella pada setiap kelompok, dengan skor maksimum 10 per larva dan skor total 100 untuk 10 larva. (C) Hasil kelangsungan hidup larva G. mellonella pada kelompok pengobatan yang berbeda setelah infeksi MRSA. (D) Foto representatif dari berbagai kelompok larva G. mellonella ( n = 10) yang terinfeksi dengan dosis mematikan S. aureus USA300 setelah pengobatan dengan ceftriaxone, TC, atau TAC. Skala batang: 1 cm. (E dan F) Beban bakteri pada larva G. mellonella yang diobati dengan ssDNA-cef, TC, dan TAC setelah infeksi MRSA, sebagaimana ditentukan oleh penghitungan pelat agar. * p < 0,05, ** p < 0,01, dan *** p < 0,001.
3.6 TAC Efektif Melawan Infeksi MRSA
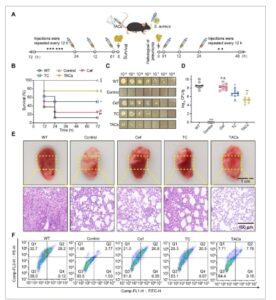
MRSA dapat menyebabkan infeksi pneumonia berat, jadi kami membuat model pneumonia akut pada tikus [ 43 ]. Eksperimen survival dilakukan melalui pemberian dosis mematikan S. aureus (2 × 108 CFU ) melalui tetes hidung, diikuti dengan pemberian nanomaterial secara subkutan (Gambar 6A ). Dibandingkan dengan kelompok kontrol dan kelompok pemberian Cef, kelompok perlakuan TAC secara efektif meningkatkan tingkat survival tikus, terutama pada periode prainfeksi, dan TAC memberikan perlindungan yang besar pada tikus, yang akhirnya menyebabkan 80% tikus bertahan hidup dari dosis mematikan infeksi MRSA USA300 (Gambar 6B ). Selanjutnya, kami menginfeksi tikus dengan dosis subletal MRSA USA300. Setelah perlakuan, tikus dikorbankan, dan jaringan paru-paru diambil untuk menilai jumlah bakteri. Pengobatan dengan TAC secara signifikan mengurangi jumlah bakteri paru-paru dari 7,45 × 107 CFU pada kelompok yang terinfeksi menjadi 4,81 × 104 CFU (Gambar 6C,D ).
GAMBAR 6
Buka di penampil gambar
Kekuatan Gambar
Efek terapeutik TAC pada model tikus pneumonia yang diinduksi MRSA. (A) Prosedur untuk menentukan tingkat kelangsungan hidup, pola patologis, dan jumlah bakteri paru-paru pada model tikus pneumonia yang diinduksi MRSA. (B) Kelangsungan hidup tikus dicatat pada interval 12 jam selama 72 jam ( n = 10); * p < 0,05, ** p < 0,01, dan *** p < 0,001 dihitung menggunakan uji log-rank. (C dan D) Sampel jaringan paru-paru dari setiap kelompok dianalisis untuk menentukan jumlah CFU bakteri yang ada. * p < 0,05, ** p < 0,01, dan *** p < 0,001 dihitung menggunakan ANOVA satu arah. (E) Perubahan patologis kasar dan analisis histopatologi jaringan paru-paru tikus. Batang skala, 1 cm dan 100 µm. (F) Proporsi neutrofil dan makrofag dalam jaringan paru-paru tikus di setiap kelompok dideteksi dengan flow cytometry. Ly6G berlabel FITC dan CD11b berlabel PE digunakan untuk membedakan dan mengukur berbagai jenis sel imun.
Selain itu, jaringan paru-paru tikus yang tidak terinfeksi tampak berwarna putih kemerahan, lembut, dan fleksibel, dengan rongga alveolus yang jelas dan bersih. Sebaliknya, jaringan paru-paru tikus yang terinfeksi MRSA tampak berwarna merah tua dengan tekstur yang keras, yang menunjukkan kongesti yang signifikan dan infiltrasi sel inflamasi di alveoli. Dibandingkan dengan pengobatan Cef, TAC secara signifikan memperbaiki infeksi paru-paru dengan memulihkan elastisitas jaringan paru-paru, mengurangi lokasi infeksi, dan mengurangi infiltrat eritrosit dan sel inflamasi di alveoli (Gambar 6E ). Hasil ini menunjukkan bahwa TAC memiliki efikasi yang sangat baik secara in vivo.
Dalam percobaan aliran, kami menggunakan pendekatan pelabelan ganda untuk mendeteksi sel berlabel Ly6G dan CD11b dalam model pneumonia tikus. Ly6G diberi label dengan FITC, sedangkan CD11b diberi label dengan PE. Hasilnya menunjukkan bahwa lebih dari 50% sel dalam kelompok WT terdistribusi dalam daerah Q1 (PE + ; FITC − ) dan Q2 (PE + ; FITC + ), yang menunjukkan bahwa kelompok ini merekrut sejumlah besar sel inflamasi dengan respons inflamasi yang nyata. Dibandingkan dengan kelompok WT, proporsi sel dalam daerah Q1 dan Q2 dalam kelompok perlakuan Cef dan TC tidak berbeda secara nyata, yang menunjukkan bahwa kedua perlakuan memiliki efek terbatas pada perekrutan sel inflamasi. Namun, dalam kelompok perlakuan TAC, proporsi sel dalam daerah Q1 dan Q2 secara signifikan lebih rendah (Gambar 6F ). Mekanisme yang digunakan nanomaterial untuk menyalurkan oligosakarida antisense ke dalam mikroorganisme untuk tujuan antimikroba telah menjadi subjek penelitian ekstensif oleh para peneliti sebelumnya [ 44 ]. Dalam penelitian ini, TAC menunjukkan efek yang nyata dalam mengurangi pelepasan faktor inflamasi dan perekrutan sel inflamasi di jaringan paru-paru tikus, yang menunjukkan bahwa TAC dapat menawarkan jalur terapi yang menjanjikan untuk pembersihan pneumonitis yang disebabkan oleh S. aureus .
Munculnya MRSA menimbulkan kesulitan yang belum pernah terjadi sebelumnya dalam pengobatan klinis [ 45 ]; namun, sedikit penelitian yang berfokus pada penanganan resistensi obat bakteri melalui nanomaterial. Nanomaterial DNA tetrahedral, yang sangat biokompatibel dan aman, telah digunakan secara luas dalam penelitian biologi [ 22 , 46 – 48 ]. Dalam penelitian ini, kami secara efektif mengurangi resistensi antibiotik MRSA dengan memuat tFNA dengan ASO mecA dan Cef sambil membuat antibiotik yang dibawa efektif untuk tindakan bakterisida. Hasil ini menunjukkan bahwa tFNA dapat digunakan sebagai pembawa pengiriman antibiotik untuk menargetkan bakteri yang resistan terhadap banyak obat dan meremajakan antibiotik lama. Cef, antibiotik β-laktam, dapat mengganggu sintesis dinding sel S. aureus , tetapi munculnya PBP2a membuat hampir semua β-laktam tidak efektif terhadap S. aureus [ 49 ]. ASO secara efektif dapat menghambat transkripsi gen pada bakteri, dan dengan demikian, PBP2a yang dikodekan mecA sangat dihambat oleh TAC, sehingga memulihkan tingkat kerentanan MRSA yang cukup besar terhadap antibiotik β-laktam.
Yang penting, mekanisme terapi TAC—berdasarkan pembungkaman mecA yang dimediasi ASO—dapat diterapkan pada gen terkait resistensi lainnya dalam kelas antibiotik yang berbeda, seperti tetrasiklin dan makrolida. In vivo, TAC menunjukkan kemanjuran antibakteri yang penting, yang menyediakan dasar bagi aplikasi klinis potensial sistem penghantaran berbasis tFNA. Selain pengobatan, TAC juga dapat dieksplorasi untuk penggunaan profilaksis pada populasi berisiko tinggi, seperti individu dengan gangguan kekebalan, pasien bedah, dan mereka yang menjalani rawat inap dalam jangka panjang. Aplikasi lokal TAC dapat membantu mengurangi kolonisasi MRSA di lokasi mukosa atau luka. Dengan menekan ekspresi mecA, ASO dapat membuat kembali strain yang berkolonisasi menjadi sensitif terhadap antibiotik β-laktam, sehingga meningkatkan efektivitas rejimen profilaksis konvensional. Lebih jauh lagi, sifat nanostruktur TAC dapat meningkatkan penetrasi biofilm dan meningkatkan aksesibilitas antibiotik dalam jaringan yang terinfeksi. Bersama-sama, temuan ini mendukung potensi tFNA sebagai platform serbaguna untuk strategi terapeutik dan pencegahan terhadap infeksi yang resistan terhadap banyak obat.
4 Kesimpulan
Singkatnya, kami menunjukkan penggunaan bahan tetrahedral DNA yang biokompatibel dan stabil, TAC, untuk mengatasi infeksi yang disebabkan oleh bakteri yang resistan terhadap obat. TAC meningkatkan kerentanan MRSA terhadap antibiotik dan meningkatkan pembunuhan bakteri yang resistan terhadap obat oleh antibiotik melalui mekanisme aksi ganda ASO yang dimuat dengan gen mecA dan Cef. Nanokompleks berhasil diendositosis oleh bakteri setelah koinkubasi, yang secara efektif menghambat ekspresi mecA dan mengurangi tingkat protein PBP2a, sehingga mengurangi proses transpeptida dalam sintesis dinding sel dan mengakibatkan ketidakmampuan MRSA untuk melawan pembunuhan yang disebabkan oleh antibiotik. Selain itu, kemanjuran Cef diperkuat melalui tFNA, yang pada akhirnya mengarah pada gangguan sintesis dinding sel dan pemberantasan bakteri. Studi in vivo menunjukkan efektivitas TAC dalam memperpanjang kelangsungan hidup, mengurangi beban bakteri dalam jaringan paru-paru tikus, dan melindungi tikus terhadap infeksi pneumonia mematikan yang disebabkan oleh MRSA. Temuan ini memberikan dasar yang kuat untuk pengembangan strategi antimikroba yang lebih maju berdasarkan nanomaterial DNA untuk eksplorasi lebih lanjut.
