ABSTRAK
Eksplorasi ketersediaan alami dan bioaktivitas intrinsik protein yang berasal dari darah membuka jalan baru untuk membuat solusi bioaktif dan khusus pasien untuk aplikasi biomedis. Meskipun memiliki beberapa keunggulan, penggunaannya sebagai tinta untuk pencetakan 3D terbatas karena sifat reologi yang kurang optimal. Untuk mengatasi hal ini, kami mengusulkan strategi dua langkah berdasarkan pembuatan awal hidrogel massal berbasis protein darah yang mencakup campuran protein murni dan fotoresponsif untuk memungkinkan granularisasi mekanisnya diikuti dengan pengacauan, yang menghasilkan tinta granular yang dapat disuntikkan dan dicetak. Dalam penelitian ini, dua matriks protein berbasis globular—lisat trombosit manusia (PL) dan albumin serum sapi (BSA)—digunakan sebagai tinta granular untuk pencetakan 3D. Kami berhipotesis bahwa pengacauan nosel—berbeda dengan pengacauan sentrifugal yang biasanya digunakan—akan memberikan hasil yang optimal untuk kemampuan proses tinta protein granular. Kemampuan cetak dievaluasi dalam filamen, kisi perancah, dan struktur berbelit-belit. Dengan memanfaatkan bagian-bagian yang dapat diawetkan dengan cahaya yang diperkenalkan sebelumnya, foto-silang pasca-cetak digunakan untuk pemanasan mikrogel, yang menghasilkan peningkatan stabilitas dan ketahanan mekanis perancah. Metodologi pengacauan nosel memberikan kinerja cetak dan reproduktifitas terbaik, di mana tinta berbasis PLMA mengungguli yang berbasis BSAMA. Selain itu, konstruksi granular mikrogel memungkinkan sel punca adiposa primer yang berasal dari manusia untuk melekat dan berkembang biak, sedangkan tinta berbasis PLMA menunjukkan afinitas sel yang lebih tinggi dan kinerja biologis yang ditingkatkan. Kami selanjutnya menunjukkan bahwa biotinta dapat dikembangkan dari tinta berbasis PLMA, yang menunjukkan viabilitas tinggi tanpa mengorbankan kinerja pencetakan 3D. Secara keseluruhan, studi ini memberikan wawasan yang jelas tentang pentingnya proses pengacauan serta persyaratan hasil granularisasi untuk memperoleh tinta granular yang sangat dapat direproduksi untuk pencetakan 3D.
1 Pendahuluan
Pencetakan ekstrusi 3D adalah teknik yang menjanjikan dan terus berkembang yang semakin menerjemahkan bahan-bahan baru ke dalam perangkat dan aplikasi rekayasa jaringan [ 1 , 2 ]. Popularitas jenis pencetakan ini pertama-tama tertanam dalam efektivitas biaya dari strategi yang dikembangkan dalam beberapa tahun terakhir [ 3 – 5 ]. Teknik ini dapat membuat perancah presisi tinggi dan personal, yang dapat menghilangkan pendekatan standar yang saat ini diterapkan dalam praktik klinis [ 6 ]. Proses ini melibatkan pengendapan tinta secara lapis demi lapis dengan kontrol spasiotemporal. Melalui kontrol pengendapan tinta yang cermat, struktur 3D yang kompleks dapat dihasilkan untuk mereplikasi arsitektur dan fungsi jaringan alami [ 7 – 10 ].
Hidrogel telah banyak digunakan sebagai tinta untuk pencetakan ekstrusi 3D karena menyediakan lingkungan yang sangat terhidrasi yang sangat menyerupai jaringan hidup, serta kemampuan untuk meniru matriks ekstraseluler tidak hanya dalam komposisi tetapi juga dalam mikrostruktur [ 11 – 13 ]. Hidrogel granular telah dengan cepat muncul sebagai platform baru untuk rekayasa jaringan, karena sifat mikromaterial dan berpori, peningkatan luas permukaan, dan fleksibilitas [ 14 – 17 ]. Ini diperoleh dengan pengacauan mikropartikel hidrogel, juga dikenal sebagai mikrogel, yang dapat diproduksi dengan berbagai teknik, termasuk elektrospray, mikrofluida, dan fragmentasi mekanis [ 15 , 18 – 20 ]. Proses pengacauan menyebabkan mikrogel menjadi bahan viskoelastis yang lembut karena interaksi yang terjadi antara mikropartikel setelah penghilangan fase air berlebih. Mikrogel individu terikat dengan gaya antarpartikel lemah yang memberikan elastisitas dan dikaitkan dengan jembatan cairan interstisial antara mikrogel yang berdekatan atau gaya gesekan [ 21 , 22 ]. Interaksi ini memberdayakan bubur mikrogel dengan viskositas dan kohesi yang sesuai, yang memungkinkannya berfungsi sebagai tinta yang tepat untuk digunakan dalam pencetakan 3D atau solusi injeksi untuk berbagai aplikasi [ 23 , 24 ]. Tinta granular ini berperilaku seperti padatan di bawah tingkat regangan rendah dan cairan di bawah tingkat regangan tinggi. Properti ini memungkinkan penggunaan virtual komposisi hidrogel apa pun sebagai tinta untuk pencetakan 3D ekstrusi karena kemampuan cetak bergantung semata-mata pada sifat fisik tinta mikrogel macet yang dihasilkan [ 25 ]. Tinta ini juga cocok untuk membuat perancah dengan porositas lebih besar daripada hidrogel massal, berkat ruang yang melekat di antara mikrogel setelah macet, yang tidak hanya akan meningkatkan infiltrasi sel, pertukaran nutrisi, dan neovaskularisasi tetapi juga dapat menghindari nekrosis pada lokasi implan [ 26 , 27 ].
Pemilihan polimer untuk pencetakan 3D ekstrusi didasarkan pada sifat reologi yang menguntungkan—terutama perilaku penipisan geser, regangan luluh, dan penyembuhan sendiri—serta biokompatibilitasnya [ 15 , 28 ]. Namun, sebagian besar polimer ini, terutama yang berasal dari sumber sintetis, tidak memiliki domain perekat untuk sel dan faktor pertumbuhan atau molekul pensinyalan yang diperlukan untuk mendukung pertumbuhan dan diferensiasi sel [ 29 – 31 ]. Untuk mengatasi keterbatasan ini, satu pendekatan yang saat ini digunakan adalah mencampur bahan yang berbeda, memanfaatkan sifat menarik dari masing-masing bahan dalam campuran: biasanya viskositas tinggi dan kandungan molekul bioaktif yang tinggi [ 32 , 33 ]. Lisat trombosit manusia (PL), yang diperoleh dari darah, adalah contoh luar biasa dari biomaterial dengan faktor pertumbuhan asli, sitokin, dan makromolekul lain yang dapat merangsang proliferasi sel, diferensiasi, dan regenerasi jaringan [ 34 – 36 ]. PL telah semakin banyak digunakan dalam aplikasi rekayasa jaringan, terutama dalam kultur sel, menggantikan suplementasi serum sapi janin tradisional, serta dalam pengembangan konstruksi rekayasa jaringan yang ditujukan pada regenerasi jaringan dan penyembuhan luka [ 37 , 38 ]. Bahan turunan darah lainnya, seperti fibrin dan fibrinogen, juga telah dieksplorasi untuk tujuan rekayasa jaringan dan digunakan sebagai biotinta [ 39 – 42 ]. Khususnya, fibrinogen telah digunakan sebagai tinta setelah gelasinya, tanpa adjuvan [ 43 ]. Namun, pekerjaan ini ditujukan untuk menghasilkan deposisi lapisan tipis yang tidak mengulangi struktur berbelit-belit. Dari semua bahan turunan darah yang secara intrinsik bioaktif, PL dan plasma kaya trombosit menonjol karena tingginya jumlah faktor pertumbuhan dan sitokin dalam komposisinya dan kemampuan untuk memicu produksi dan deposisi ECM baru. Lebih lanjut, PL dapat disimpan tanpa batas waktu dan tidak memiliki hambatan pembekuan terkait fibrin, tidak seperti protein turunan darah lainnya. Selain itu, bahan ini semakin dikenal sebagai alternatif bebas xenogenik untuk serum sapi janin dalam kultur sel [ 38 ]. Meskipun demikian, penggunaannya sebagai hidrogel atau tinta untuk perancah pencetakan terbatas karena sifat reologinya yang lemah [ 44 ]. Untuk mengatasi tantangan ini, bahan yang berasal dari darah biasanya digunakan dalam kombinasi dengan matriks lain seperti gelatin atau asam hialuronat untuk meningkatkan viskositas tinta [ 42 , 45 , 46 ]. Baru-baru ini, tinta yang terdiri dari komponen PL secara unik telah dilaporkan [ 47 , 48] .]. Hal ini telah menunjukkan kelayakan melalui metode yang berbeda—rekayasa tinta dan dukungan pencetakan 3D berbantuan bak mandi—termasuk sel endotel dalam formulasi biotinta yang melekat dan berkembang biak, menjadi indikator awal sifat pro-angiogeniknya.
Dalam studi ini, kami mengusulkan untuk lebih jauh mengeksplorasi bahan-bahan ini untuk mengembangkan struktur cetak 3D dengan kompleksitas yang lebih tinggi, sebuah kelemahan yang disebutkan dalam studi sebelumnya [ 47 ], dengan mengedepankan proses pengacauan mikrogel yang serbaguna dan sangat dapat direproduksi. Kami melaporkan sebuah metodologi untuk mengubah bahan-bahan dengan viskositas rendah ini menjadi tinta granular yang berputar pada ikatan kovalen campuran protein yang dimetakrilat dan tidak dimetakrilat untuk membentuk hidrogel massal. Hidrogel ini kemudian difragmentasi secara mekanis menggunakan jarum pengukur yang semakin besar untuk menghasilkan mikrogel. Kami lebih jauh mengeksplorasi keserbagunaan metode ini dengan menilai pengembangan tinta granular menggunakan dua protein yang berasal dari darah—PL dan albumin—yang memiliki aplikasi langka sebagai bahan tunggal untuk aplikasi pencetakan 3D, terutama ketika menghindari penggunaan bak pendukung. Selain itu, kami berhipotesis bahwa metodologi pengacauan alternatif dapat menghasilkan hasil dan reproduktifitas yang lebih tinggi dibandingkan dengan metodologi tradisional, dan kami lebih jauh mengkarakterisasi efeknya pada perilaku pencetakan tinta ini. Dengan mempertimbangkan porositas, sifat reologi, dan biokompatibilitas dari tinta berbasis PLMA dan albumin, kami akhirnya memvalidasi perolehan tinta granular secara langsung dari bahan yang berasal dari darah, yang membuka kemungkinan baru untuk pemanfaatan terapi yang berasal dari pasien.
2 Hasil dan Pembahasan
2.1 Mikrogel yang Diperoleh dari Matriks yang Berasal dari Darah
Dasar pemikiran kami untuk memproduksi tinta granular melibatkan dua tahap ikatan silang: yang pertama (berbasis kimia) untuk membentuk prekursor hidrogel dari mana mikrogel diproduksi, dan yang kedua (berbasis cahaya) untuk memanaskan mikrogel setelah pencetakan 3D. Oleh karena itu, untuk memungkinkan fotoikatan silang filamen pasca-ekstrusi, PL dan BSA dimetaksilasi menggunakan anhidrida metakrilat (MA), yang menargetkan gugus amino dan hidroksil dalam protein ini. Protein metaksilasi (lisat trombosit manusia termetakrilat [PLMA] dan albumin serum sapi termetakrilat [BSAMA]) menyajikan gugus yang dapat mengikat secara kovalen saat terkena cahaya dengan adanya fotokatalis [ 46 , 49 – 51 ]. Spektrum 1 H-NMR dari BSA, BSAMA, PL, dan PLMA dapat dilihat pada Gambar S1 , yang menunjukkan modifikasi kedua protein yang berhasil. Spektrum protein yang dimetakrilasi memiliki dua puncak dalam kisaran 5,2 dan 5,7 ppm, yang sesuai dengan proton akrilik, bersama dengan puncak pada 2,0 ppm, yang menunjukkan proton metil, yang mengonfirmasi metakrilasi [ 51 ]. Derajat modifikasi, yang diperoleh menggunakan uji kolorimetri OPA, adalah 81,2 ± 2,7% untuk BSAMA dan 48,0 ± 7,7% untuk PLMA. Karena PL hanya mengandung hampir 40% albumin, diantisipasi bahwa PLMA akan memiliki derajat modifikasi yang lebih rendah karena jumlah gugus yang tersedia untuk bereaksi dengan MA lebih sedikit. Oleh karena itu, selama pekerjaan, kami menyesuaikan konsentrasi larutan prekursor dengan mempertimbangkan derajat modifikasinya.
Setelah protein berhasil dimodifikasi, langkah berikutnya adalah mengikat silang secara kimia dengan protein yang tidak dimodifikasi. Gambar 1 merangkum alur kerja untuk memperoleh tinta granular. Secara singkat, protein yang berasal dari darah yang dimetakrilat dan tidak dimetakrilat dari kedua larutan prekursor dicampur dalam rasio 1:1 (BSA ke BSAMA, PL ke PLMA), dan N -etil- N ʹ-(3-(dimetilamino)propil)karbodiimida (EDC) dan N -hidroksisuksimida (NHS) ditambahkan ke dalam campuran. EDC adalah pengikat silang kimia dengan panjang nol dan NHS bertanggung jawab untuk menstabilkan reaksi. Hasilnya adalah pembentukan ikatan amida baik di dalam maupun di antara gugus karboksil bawaan larutan prekursor dan amina primer, yang menciptakan hidrogel ikatan silang yang stabil (Gambar 1 ). Reaksi ini menghasilkan hidrogel massal untuk fragmentasi mekanis posterior menjadi mikrogel. Penting untuk ditekankan bahwa hal ini tidak memungkinkan ketika hanya menggunakan larutan protein yang dimodifikasi (yaitu, PLMA atau BSAMA), seperti yang sebelumnya ditunjukkan oleh kelompok kami [ 47 ]. Hal ini disebabkan oleh berkurangnya jumlah amina primer yang tersedia, setelah reaksi metakrilasi, untuk bereaksi dengan pengikat silang. Jumlah EDC/NHS dioptimalkan untuk jumlah minimum untuk memungkinkan pembentukan hidrogel massal untuk pembuatan mikrogel. Selain itu, hidrogel ini harus mencapai persyaratan kekakuan dan elastisitas, karena terlalu lunak atau terlalu elastis dapat menghambat fragmentasi mekanis hidrogel massal melalui ekstrusi jarum dan, oleh karena itu, produksi mikrogel [ 52 ].
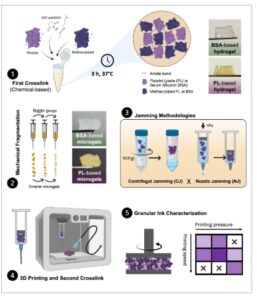
GAMBAR 1
Buka di penampil gambar
Presentasi PowerPoint
Alur kerja untuk persiapan tinta granular melalui ikatan silang kimia pertama, diikuti oleh metode fragmentasi mekanis dan pengacauan; pencetakan dengan ikatan silang kedua berbasis cahaya pascacetak; dan karakterisasi tinta. Dibuat dengan BioRender.
Metode yang dipilih untuk membuat mikrogel adalah fragmentasi mekanis, yang melibatkan ekstrusi hidrogel massal melalui serangkaian jarum pengukur yang semakin besar (Gambar 1 dan 2 ). Dengan menggunakan mikrogel, kami mempelajari bagaimana dua proses pengacauan yang berbeda, yaitu pengacauan nosel dan pengacauan sentrifugal (CJ) (Gambar 1 dan 3 ), dapat memengaruhi hasil cetak akhir (Gambar 1 dan 4 ) serta data reologi (Gambar 1 dan 5 ).
GAMBAR 2
Buka di penampil gambar
Presentasi PowerPoint
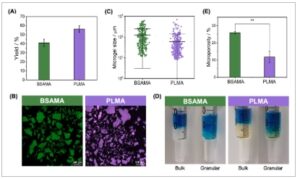
(A) Persentase hasil rata-rata produksi mikrogel berbasis BSAMA dan PLMA melalui fragmentasi mekanis. (B) Gambaran mikroskopi makroskopis dan fluoresensi tinta granular. (C) Analisis distribusi ukuran mikrogel hasil fragmentasi mekanis. (D) Visualisasi tinta setelah uji infiltrasi pewarna untuk kontrol massal dan formulasi granular. (E) Persentase mikroporositas tinta granular berbasis BSAMA dan PLMA. Skala batang: 500 µm.
GAMBAR 3
Buka di penampil gambar
Presentasi PowerPoint
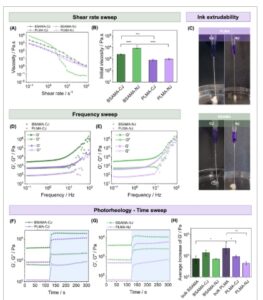
(A) Sapuan laju geser untuk penilaian viskositas dan perilaku pengenceran geser dari formulasi tinta. (B) Viskositas awal formulasi tinta yang diperoleh dari sapuan laju geser. (C) Pengujian ekstrudabilitas tinta dari tinta granular berbasis PLMA dan BSAMA melalui nosel 21 G menggunakan pompa. (D, E) Sapuan frekuensi dari formulasi tinta yang mengalami pengacauan sentrifugal dan pengacauan nosel, masing-masing. (F, G) Sapuan waktu fotoreologi dari formulasi tinta yang mengalami pengacauan sentrifugal dan pengacauan nosel, masing-masing; menggunakan paparan cahaya pada t = 120 d. (H) Peningkatan modulus penyimpanan rata-rata setelah fotocrosslinking (perbedaan modulus sebelum dan setelah paparan cahaya).
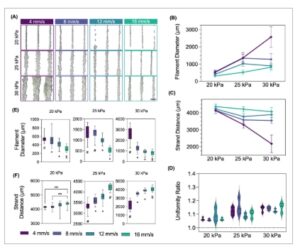
GAMBAR 4
Buka di penampil gambar
Presentasi PowerPoint
(A) Filamen cetak 3D dari nosel PLMA yang macet dengan tinta menggunakan tiga tekanan ekstrusi (20, 25, dan 30 kPa) dan empat kecepatan cetak (4, 8, 12, dan 16 mm/s). Skala batang = 1 mm. (B) Hasil diameter filamen untuk untaian cetak disajikan dalam (A). (C) Jarak untaian filamen cetak disajikan dalam (A). (D) Rasio keseragaman untaian cetak disajikan dalam (A). (E) Diameter filamen filamen cetak ditampilkan oleh tekanan ekstrusi yang digunakan. (F) Jarak untaian filamen cetak ditampilkan oleh tekanan ekstrusi. * p < 0,01, ** p < 0,001, dan *** p < 0,0001.
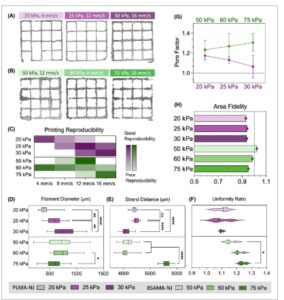
GAMBAR 5
Buka di penampil gambar
Presentasi PowerPoint
(A, B) Kisi-kisi 20 × 20 mm yang dicetak 3D dari tinta PLMA-NJ dan BSAMA-NJ masing-masing berwarna ungu dan hijau. Skala batang = 1 mm. (C) Peta panas reproduksibilitas pencetakan untuk kecepatan dan tekanan pencetakan yang diuji. (D) Diameter filamen diukur dari kisi-kisi cetak yang disajikan dalam (A) dan (B). (E) Jarak untai antara filamen kisi-kisi cetak disajikan dalam (A) dan (B). (F) Rasio keseragaman filamen kisi-kisi cetak disajikan dalam (A) dan (B). (G) Faktor pori kisi-kisi cetak disajikan dalam (A) dan (B). (H) Kesetiaan area kisi-kisi cetak disajikan dalam (A) dan (B).
Gambar 2A menyajikan rata-rata persentase hasil produksi mikrogel berbasis BSAMA dan PLMA melalui fragmentasi mekanis. Tinta berbasis BSAMA memiliki hasil produksi sebesar 40,9 ± 4,1% dan berbasis PLMA sebesar 56,2 ± 3,5%. Kami berhipotesis bahwa hasil yang lebih tinggi dalam produksi mikrogel terkait dengan konsentrasi protein yang lebih tinggi dari prekursor massal berbasis PLMA. Gambar mikroskopi konfokal mikrogel yang dihasilkan ditampilkan dalam Gambar 2B , dan distribusi ukurannya ditampilkan dalam Gambar 2C . Proses ekstrusi menghasilkan mikrogel tanpa morfologi spesifik atau ukuran terkontrol, menghasilkan mikropartikel tidak teratur dengan diameter berkisar antara 10 hingga 1000 µm. Untuk menentukan diameter ini, luas setiap mikrogel dihitung dan dianggap sebagai luas lingkaran sempurna. PLMA memiliki jumlah mikrogel yang lebih kecil secara signifikan lebih tinggi dibandingkan dengan BSAMA, menghasilkan diameter rata-rata 68 ± 82 µm untuk mikrogel berbasis PLMA dan 125 ± 122 µm untuk mikrogel berbasis BSAMA. Produksi mikrogel mengikuti metodologi ini sebelumnya dilaporkan untuk asam hialuronat, di mana mikrogel yang dihasilkan juga menunjukkan distribusi ukuran yang luas dan geometri yang tidak teratur [ 33 ]. Fragmentasi mekanis juga telah digunakan untuk menghasilkan mikrogel monodispersi dan mikrountai terjerat dengan menggunakan blender atau ekstrusi berbasis grid, masing-masing [ 53 , 54 ]. Meskipun metodologi ini tidak memiliki kendali atas ukuran dan morfologi mikrogel yang dihasilkan, metodologi ini dapat dengan mudah ditingkatkan pada tingkat produksi yang cepat dan berbiaya rendah, juga bebas dari langkah pencucian yang meningkatkan hasil yang lebih rendah.
Salah satu sifat utama tinta granular, khususnya dalam aplikasi rekayasa jaringan, adalah mikroporositas yang berasal dari ruang antara mikrogel pasca-pengereman. Fitur ini memfasilitasi migrasi sel di seluruh struktur perancah dan pertukaran nutrisi yang efisien, aspek yang sering terhalang oleh hidrogel massal yang umumnya menunjukkan nanoporositas [ 27 , 55 ]. Untuk mengevaluasi fitur ini, kami menggunakan metode infiltrasi pewarna seperti yang dijelaskan sebelumnya (Gambar 2D ) [ 31 , 56 ]. Dalam metode ini, jumlah pewarna yang diinfiltrasi ke dalam hidrogel massal dan granular ditentukan dengan menghitung perbedaan antara massa awal larutan pewarna dan larutan yang tersisa dalam spuit. Mikroporositas yang diperoleh dari hidrogel granular BSAMA hampir dua kali lipat (25,9 ± 0,8%) dari konstruksi PLMA granular (11,8 ± 3,4%), seperti yang disajikan pada Gambar 2E . Perbedaan ini dapat dijelaskan oleh fakta bahwa PLMA memiliki jumlah mikrogel yang lebih besar, yang dapat mengisi ruang antara mikrogel yang lebih besar, sehingga mengurangi mikroporositas akhir. Selain itu, penelitian telah menunjukkan bahwa tinta granular yang berasal dari mikrogel berukuran rata-rata yang lebih kecil sering kali menunjukkan porositas yang berkurang, begitu pula yang terbentuk dari mikrogel yang lebih lunak, yang mudah berubah bentuk dan menempati ruang, yang juga menjelaskan mikroporositas yang lebih rendah dari tinta berbasis PLMA [ 26 , 57 ].
2.2 Metodologi Jamming dan Karakterisasi Rheologi
Mengidentifikasi metode pengacauan yang tepat untuk mencapai pengemasan yang optimal sangatlah penting. Tingkat pemadatan mikrogel dapat sangat memengaruhi hasil cetak. Jika hidrogel kurang terkelupas, tinta akan keluar bersama air yang berlebih, sedangkan jika terkelupas secara berlebihan, mikrogel hanya dapat keluar melalui kerusakan mekanis [ 24 , 58 ]. Oleh karena itu, kami meneliti efek yang dapat ditimbulkan oleh dua metodologi pengacauan yang berbeda terhadap perolehan tinta granular yang dapat dicetak.
CJ terdiri dari sentrifugasi mikrogel menggunakan unit filter yang menahan mikrogel sambil membiarkan air mengalir melewatinya. Metode ini menunjukkan praktik standar untuk memperoleh tinta granular untuk pencetakan 3D ekstrusi [ 59 ]. Di sisi lain, kemacetan nosel (NJ) sebelumnya dilaporkan sebagai proses kemacetan yang dapat terjadi pada awal proses pencetakan. Metodologi ini mensyaratkan bahwa bubur mikrogel, yang ditempatkan di kartrid cetak, dikenakan tekanan hampir ekstrusi melalui nosel pencetakan, yang menggantikan air [ 24 ].
Setelah menggunakan kedua metode untuk hidrogel granular berbasis PLMA dan BSAMA, kami menemukan bahwa menghilangkan langkah sentrifugasi menghasilkan tinta granular yang lebih dapat direproduksi dan disesuaikan. CJ secara efektif mencapai tujuan yang diinginkan, namun, mengingat sifat prosesnya, ada kemungkinan terbatas untuk menyesuaikan tingkat kemacetan. Hal ini menyebabkan interaksi antarpartikel berkurang, menghasilkan kemampuan proses yang lebih heterogen dan sulit. Kami berhipotesis bahwa gaya sentrifugal yang diperlukan untuk kemacetan kurang dan kelebihan sangat mirip. Hal ini membuat metode tersebut tidak memiliki kendali atas tingkat kemacetan. Sebaliknya, NJ memungkinkan pengguna mengendalikan tekanan kemacetan dengan tepat, dan tingkat penyesuaian ini memfasilitasi pengoptimalan khusus untuk (bio)tinta, peralatan, dan aplikasi. Oleh karena itu, dengan mempertimbangkan peran penting dari proses kemacetan, kami mengevaluasi dan membandingkan efek dari kedua metode kemacetan pada sifat reologi dan kinerja pencetakan tinta granular berbasis BSAMA dan PLMA.
2.2.1 Karakterisasi Reologi
Karakterisasi reologi dilakukan untuk menilai sifat material yang penting untuk kemampuan cetak, serta stabilitasnya sebelum dan sesudah fotocrosslinking. Untuk ini, formulasi massal kontrol, serta CJ dan NJ untuk tinta berbasis BSAMA dan PLMA, dianalisis. Daerah viskoelastis linear ditentukan melalui sapuan regangan (Gambar S2A–C ). Semua formulasi menunjukkan perilaku elastis yang dominan (Gʹ > G″) [ 60 ]. Kecuali untuk formulasi massal, yang berperilaku terbalik, tinta berbasis PLMA selalu menyajikan modulus elastis dan viskos yang lebih rendah daripada tinta berbasis BSAMA dalam sapuan regangan, yang dapat dibenarkan oleh ukuran mikrogel rata-rata yang lebih kecil [ 24 , 58 , 61 ].
Baik tinta maupun proses pengacauan juga diuji untuk perilaku pengenceran geser dengan sapuan laju geser (Gambar 3A ). Semua formulasi menunjukkan pengurangan viskositas dengan peningkatan laju geser, yang mengonfirmasi perilaku pengenceran geser, yang penting untuk pencetakan ekstrusi [ 62 ]. Viskositas awal formulasi berbasis BSAMA lebih besar daripada yang berbasis PLMA (Gambar 3B ). Lebih jauh, proses pengacauan memengaruhi viskositas tinta, dengan tinta NJ menunjukkan viskositas awal yang lebih tinggi. Ini, dipadukan dengan modulus penyimpanan yang lebih tinggi dari tinta NJ yang dinilai dari sapuan regangan, menunjukkan fitur reologi penting untuk memperoleh tinta yang dapat dicetak. Fitur-fitur ini tampaknya terkait dengan pengacauan yang lebih efisien dan ukuran mikrogel yang sesuai [ 58 , 61 ]. Pada Gambar 3C , uji ekstrusi tinta granular dicontohkan, yang menunjukkan kemampuannya untuk membentuk filamen kohesif melalui jarum 21 G untuk tinta berbasis BSAMA dan PLMA. Dari gambar-gambar ini, tampak jelas bahwa CJ menghasilkan filamen tidak beraturan saat ekstrusi menggunakan pompa, berbeda dengan NJ, yang menghasilkan filamen dan tepi yang kontinu dan halus, indikator awal peningkatan kinerjanya pada prosedur pencetakan ekstrusi 3D.
Uji sapuan frekuensi juga dilakukan untuk menilai perilaku dan integritas formulasi sebagai tinta untuk pencetakan 3D ekstrusi. Gambar 3D,E dan Gambar S2G menyajikan sapuan yang dilakukan sebelum foto-silang untuk kontrol CJ, NJ, dan massal, masing-masing. Semua formulasi stabil hingga sekitar 10 Hz. Ini membuktikan bahwa semua formulasi tinta, di bawah regangan kritis ini, memiliki modulus elastisitas yang hampir tidak bergantung pada frekuensi, seperti yang diharapkan dari bahan seperti padatan.
Kinetika fotocrosslinking dari semua formulasi dinilai dengan sapuan waktu dengan paparan cahaya. Gambar 3F,G dan Gambar S2D menunjukkan hasil yang diperoleh untuk kontrol CJ, NJ, dan massal, masing-masing. Semua formulasi dengan cepat distabilkan melalui fotocrosslinking melalui pembentukan ikatan kovalen antara rantai protein yang ada di dalam dan di dalam mikrogel yang macet. Modulus penyimpanan setiap formulasi dan kontrol massal ditampilkan sebelum dan setelah fotocrosslinking diplot pada Gambar S2E,F masing-masing. Sebelum paparan cahaya, hanya ada perbedaan statistik antara formulasi berbasis BSAMA dan PLMA, dan tidak antara proses pengacauan. Tinta berbasis BSAMA menyajikan Gʹ yang lebih tinggi daripada berbasis PLMA. Ini diharapkan mengingat apa yang kami rasakan bahwa ada tingkat pengacauan yang lebih tinggi untuk tinta berbasis BSAMA, terutama mengingat distribusi ukuran dan hasil mikroporositasnya (Gambar 2 ) [ 58 , 61 ]. Menariknya, setelah paparan cahaya, Gʹ dari semua formulasi diratakan, tanpa perbedaan statistik antara proses pengacauan, hanya Gʹ yang sedikit lebih rendah untuk tinta berbasis PLMA dibandingkan dengan kontrol massal. Sekali lagi, ini dapat dijelaskan oleh tingkat pengacauan. Peningkatan Gʹ melalui foto-silang-ikatan disajikan pada Gambar 3H . Perlu dicatat juga bahwa kontrol massal menunjukkan deviasi standar Gʹ yang lebih tinggi, yang dapat menjadi indikasi reproduktifitasnya yang lebih rendah. Sapuan frekuensi yang dilakukan setelah paparan cahaya (Gambar S2H,I ) mengonfirmasi stabilitas tinta foto-silang.
Secara keseluruhan, karakterisasi reologi dari kedua proses pengacauan dan tinta memungkinkan kita untuk memahami bahwa tinta berbasis BSAMA, yang tersusun dari mikrogel yang lebih besar dan lebih lembut, lebih mudah diacau. Hal ini menghasilkan viskositas awal yang lebih tinggi dan Gʹ yang lebih tinggi dibandingkan dengan tinta berbasis PLMA. Pada gilirannya, tinta berbasis PLMA, yang dibentuk oleh mikrogel yang lebih kecil dan lebih kaku, menghasilkan tinta dengan viskositas awal yang lebih rendah dengan Gʹ yang lebih rendah, sambil menerapkan metodologi pengacauan yang sama. Mengingat sifat yang beragam dari kedua tinta tersebut, perancah yang dicetak dapat disesuaikan secara khusus untuk menunjukkan tingkat kekakuan yang sangat cocok dengan sifat mekanis jaringan target [ 63 ]. Karena tinta berbasis BSAMA sedikit lebih kaku daripada tinta berbasis PLMA, di sini, berbagai aplikasi rekayasa jaringan dapat diusulkan: misalnya, perancah berbasis BSAMA mungkin lebih sesuai untuk rekonstruksi jaringan payudara, yang memerlukan kekakuan yang sedikit lebih tinggi, berkisar antara 20 hingga 40 kPa, dan porositas yang lebih tinggi [ 64 ]. Sebaliknya, perancah berbasis PLMA, dengan kekakuan di bawah 10 kPa dan menampilkan struktur yang lebih padat dan berporositas lebih rendah, bisa lebih cocok untuk regenerasi jaringan hati [ 63 ]. Aplikasi lain, seperti tinta untuk rekayasa jaringan osteochondral dan antarmuka, juga dapat diusulkan, mengingat ada kemungkinan melakukan gradien kekakuan dan mikroporositas selama pencetakan 3D; misalnya, tulang rawan akan membutuhkan porositas dan kekakuan yang lebih rendah (tinta PLMA), sementara migrasi ke jaringan tulang akan membutuhkan porositas dan kekakuan yang lebih tinggi (misalnya, migrasi dari PLMA ke tinta berbasis BSAMA) [ 65 ]. Untuk lebih lanjut menilai perbedaan antara kedua metode pengacauan pada kemampuan cetak 3D, kami beralih ke evaluasi kinerja pencetakan menggunakan analisis fidelitas filamen.
2.3 Evaluasi Kemampuan Cetak 3D
2.3.1 Analisis Kesetiaan Filamen
Tinta BSAMA- dan PLMA-CJ awalnya dinilai untuk pencetakan 3D ekstrusi menggunakan geometri dan desain berbeda yang dicetak dengan nosel ukuran 22 (masing-masing Gambar S3A,B ). Seperti yang digambarkan, struktur dapat dengan mudah dimanipulasi tanpa mengorbankan bentuk atau integritas strukturalnya. PLMA-CJ memerlukan tekanan pencetakan yang jauh lebih rendah jika dibandingkan dengan BSAMA-CJ (30z vs. 120 kPa). Ini mengonfirmasi karakterisasi reologi yang dilakukan dan kemungkinan terkait dengan mikrogel yang lebih besar yang lebih rentan terhadap penyumbatan nosel. Sebaliknya dengan PLMA-CJ, BSAMA-CJ lebih kental, mengonfirmasi penilaian viskometri, tetapi memerlukan lebih banyak putusnya filamen dan ketidakakuratan pencetakan. Kedua tinta memerlukan kecepatan pencetakan yang sangat lambat sekitar 2–4 mm/dtk. Kewajiban ini membuktikan buruknya kemampuan alir dan kurangnya perilaku responsif terhadap tekanan dan kecepatan. Belum ada pemahaman yang jelas tentang sifat reologi yang diperoleh dan kemampuan cetak terkait metode pengacauan dan sifat mikrogel [ 59 ]. Kita dapat melihat bahwa tinta yang terlalu banyak/terlalu banyak macet cenderung memerangkap udara dan membentuk rongga. Kami berhipotesis bahwa rongga ini bertanggung jawab atas heterogenitas tinta CJ selama pencetakan. Rongga dapat menimbulkan cacat yang menyebabkan konsentrasi tegangan dan mengurangi perilaku elastis tinta, dan pembentukannya diintensifkan dengan mikrogel yang lebih besar [ 58 , 61 ]. Meskipun kami tidak dapat menunjukkan pengoptimalan kemampuan cetak tambahan karena kurangnya sifat responsif terhadap tekanan dan kecepatan pencetakan mikrogel CJ, hasil ini mengonfirmasi dampak kandungan air mikrogel terhadap kemampuan cetak, yang memotivasi kami untuk mengeksplorasi lebih detail pengaruh metodologi pengacauan NJ dalam pencetakan 3D.
Bahasa Indonesia: Saat mencetak tinta NJ, persyaratan tekanan minimum untuk ekstrusi adalah ∼20 kPa untuk PLMA-NJ dan ∼40 kPa untuk BSAMA-NJ, penurunan signifikan dari nilai awal yang diperlukan untuk tinta CJ. Gambar S4 menggambarkan penilaian ekstrudabilitas tinta PLMA-NJ dengan nosel pengukur yang berbeda dan persyaratan tekanan minimum untuk masing-masing. Nosel pengukur 22 mengekstruksi filamen tertipis tanpa mengorbankan ekstrusi berkelanjutan dan/atau penyumbatan sementara juga memungkinkan tekanan yang lebih rendah untuk ekstrusi jika dibandingkan dengan diameter yang lebih kecil seperti 25G. Oleh karena itu, nosel pengukur 22 juga digunakan seterusnya. Tinta ini digunakan untuk mencetak filamen dengan tiga tekanan dan kecepatan cetak yang bervariasi, yang mikrograf representatifnya digambarkan dalam Gambar 4A dan Gambar S5A , untuk PLMA-NJ dan BSAMA-NJ, masing-masing. Diameter filamen tinta PLMA-NJ diukur, menunjukkan ketergantungan yang jelas pada tekanan dan kecepatan cetak. Tekanan yang lebih tinggi menyebabkan diameter filamen meningkat, ditunjukkan pada Gambar 4B . Hal yang sama terjadi dengan penurunan kecepatan cetak. Ini adalah perilaku yang diinginkan dari tinta dengan sifat yang sesuai untuk pencetakan ekstrusi, yang responsif terhadap tekanan dan kecepatan. Jarak untai juga dapat menginformasikan penyebaran filamen yang dihasilkan (ditampilkan pada Gambar 4C ). Kami dapat melihat bahwa hasil ini selaras dengan diameter filamen, dengan peningkatan diameter menghasilkan jarak untai yang lebih kecil. Keseragaman filamen juga dievaluasi, menginformasikan bentuk filamen, di mana tepi lurus dan halus berhubungan dengan rasio keseragaman yang paling dekat dengan 1. Kami dapat mengamati bahwa rasio keseragaman sebagian besar tidak bergantung pada kecepatan cetak (Gambar 4D ). Gambar 4E,F menyajikan hasil diameter filamen dan jarak tegakan secara terpisah untuk setiap tekanan cetak, masing-masing, untuk visualisasi yang jelas tentang ketergantungan pada kecepatan cetak. Kecepatan cetak tertinggi menunjukkan hasil diameter filamen yang lebih konsisten. Untuk jarak untai, perilaku yang sama terjadi, dan tekanan yang lebih rendah (20 kPa), bersama dengan kecepatan cetak yang tinggi, menunjukkan nilai yang lebih konsisten. Namun, dengan mempertimbangkan gambar mikrograf (Gambar 4A ), kondisi ini menghasilkan filamen yang kurang kohesif dan lebih banyak filamen yang putus. Sebaliknya, saat menggunakan 25 dan 30 kPa bersama dengan kecepatan cetak yang lebih tinggi, kami dapat memperoleh hasil filamen, fidelitas, dan keseragaman yang lebih baik. Untuk tinta BSAMA-NJ, pengukuran yang sama dilakukan, di mana perilaku tinta tidak konsisten. Filamen yang diperoleh (Gambar S5A ) membuktikan kurangnya perilaku linier antara tekanan cetak dan kecepatan yang diterapkan dan diameter filamen, jarak untai, dan rasio keseragaman yang dihasilkan (Gambar S5B,C,D), masing-masing). Tampaknya, hasil fidelitas filamen terbaik adalah untuk kecepatan ekstrusi tertinggi, sementara juga memerlukan putusnya filamen paling banyak selama ekstrusi. Oleh karena itu, mengingat responsivitas tinta yang sudah mapan, kita dapat menyimpulkan bahwa keseragaman filamen lebih bergantung pada sifat dan properti tinta, bahan, atau metodologi ikatan silang daripada parameter pencetakan.
Dibandingkan dengan CJ, penggunaan NJ menawarkan penurunan yang signifikan dalam persyaratan tekanan pencetakan. Selain itu, terungkap bahwa ini merupakan metodologi yang lebih dapat direproduksi yang memungkinkan pengoptimalan proses pencetakan dengan reproduktifitas yang tinggi. Lebih jauh, mikrogel yang lebih rentan terhadap over-jamming akan sangat diuntungkan dari penggunaan NJ, karena memerlukan penyetelan pada tingkat pengacauan. NJ dapat menutup lebih banyak skalabilitas, reproduktifitas, dan penerapan yang luas. Mengingat bahwa proses berlangsung di peralatan pencetakan, skalabilitas tidak terpengaruh, menjadi proses pengacauan tanpa hambatan penskalaan atau biaya terkait dan persyaratan waktu. Selain itu, modularitas NJ dan persyaratan tekanan pencetakan yang rendah dapat menawarkan penerapan yang tak tertandingi untuk penyertaan dan pematangan sel-sel tertentu, yang akan dievaluasi kemudian.
2.3.2 Penilaian Kemampuan Cetak Grid
Kisi-kisi diproduksi untuk menilai lebih lanjut fidelitas cetak tinta NJ dalam struktur yang lebih kompleks dan membandingkannya dengan hasil sebelumnya. Gambar 5A, B memamerkan mikrograf kisi cetak untuk PLMA-NJ dan BSAMA-NJ, masing-masing. Tekanan dan kecepatan cetak optimal yang memberikan reproduktifitas terbaik dalam analisis fidelitas filamen digunakan, dan reproduktifitas cetak dinilai (Gambar 5C ). Hasil diameter filamen dan jarak untai pada kisi cetak (Gambar 5D, E ) mengonfirmasi bahwa untuk PLMA-NJ, peningkatan tekanan memerlukan kecepatan cetak yang lebih tinggi, yang menunjukkan perilaku responsifnya. Di sisi lain, tinta berbasis BSAMA menunjukkan perilaku yang lebih tidak konsisten dan tidak responsif, yang menguatkan hasil sebelumnya (Gambar 5F ).
Faktor pori dinilai (Gambar 5G ), di mana nilai di atas satu secara prediktif berhubungan dengan tinta yang dianggap over-crosslinked, yang mengarah ke filamen dengan keseragaman yang lebih rendah, nilai yang diamati untuk kedua tinta. Untuk berbasis PLMA, nilai yang paling dekat dengan ideal dicapai dengan tekanan cetak yang lebih tinggi (1,06 ± 0,11). Sebaliknya diamati untuk berbasis BSAMA dengan hasil terbaik untuk tekanan cetak terendah (1,24 ± 0,09). Meskipun demikian, tidak ditemukan perbedaan statistik antara tekanan yang digunakan untuk kedua tinta. Rasio area grid membuktikan seberapa mirip struktur cetak dengan model STL yang digunakan, di mana nilai yang mendekati 1 berhubungan dengan struktur dengan fidelitas cetak yang optimal. Rasio area keseluruhan dari konstruksi cetak berbasis PLMA terbukti tidak terpengaruh oleh peningkatan tekanan (fidelitas area ~ 0,94 ± 0,01), sedangkan grid berbasis BSAMA kehilangan fidelitas dengan peningkatan tekanan cetak (Gambar 5H ).
Hasil-hasil ini menguatkan kemampuan proses dan perilaku responsif tinta berbasis PLMA, yang selaras dengan pengamatan sebelumnya (Gambar 4 dan Gambar S5 ). Tinta berbasis PLMA terbukti lebih dapat direproduksi dan homogen, memerlukan tekanan yang lebih rendah dan menunjukkan kemampuan cetak yang lebih baik. Secara keseluruhan, 25 kPa dan 12 mm/s menghasilkan kinerja pencetakan terbaik dengan kemampuan reproduksi dan hasil terbaik. Meskipun tinta berbasis BSAMA juga dapat digunakan untuk mencetak struktur, tinta tersebut menunjukkan kurangnya kemampuan reproduksi, lebih heterogen, dan menunjukkan perilaku yang tidak responsif. Dengan demikian, kami melanjutkan untuk mencetak struktur yang lebih berbelit-belit menggunakan tinta PLMA-NJ.
2.3.3 Pencetakan Geometri Multi-Lapisan dan Kompleks
PLMA-NJ kemudian digunakan untuk membuat struktur yang lebih kompleks untuk membuktikan kemampuan cetak tinta ini untuk konstruksi rekayasa jaringan tingkat lanjut. Gambar 6A menyajikan alur kerja yang terlibat dalam proses pencetakan dan evaluasinya dari gambar mikroskopi. Secara singkat, model stereolitografi yang dipilih dipotong langsung dalam perangkat lunak bioprinter, menghasilkan kode-G yang sesuai, di mana, setelah setiap lapisan diendapkan, fotocrosslinking terjadi. Pencetakan tinta lunak sering kali terhambat oleh retensi bentuk yang rendah dan aliran kental, yang menghasilkan diameter filamen di atas optimal karena penyebaran filamen. Ini sangat sulit ketika mencoba mencetak struktur yang tinggi atau sempit, serta sudut lancip [ 66 ]. Oleh karena itu, kami bertujuan untuk mencetak model yang menantang untuk membuktikan kemampuan cetak tinta ini untuk mencapai ukuran dan geometri yang relevan secara klinis, yang menunjukkan keserbagunaan dan reproduktifitas. Dengan cara ini, dua silinder 10 mm dicetak, satu dengan 7 lapisan dan lainnya dengan 24 lapisan (Gambar 6B ). Selain itu, konstruksi berbentuk bintang dicetak dengan ukuran yang semakin besar: bintang berukuran 10 × 10 mm dan bintang berukuran 20 × 20 mm, seperti yang digambarkan pada Gambar 6C [ 51 ]. Gambar S6A–H menyajikan gambar mikroskopi yang digunakan untuk penilaian kemampuan cetak. Kami mengukur ketepatan cetak konstruksi ini dengan membandingkan tinggi konstruksi secara keseluruhan, keseragaman deposisi, dan rasio luas struktur dengan model stereolitografi yang digunakan.

GAMBAR 6
Buka di penampil gambar
Presentasi PowerPoint
(A) Alur kerja pencetakan 3D dan penilaian kemampuan cetak. (B) Struktur PLMA silinder cetak 3D dengan kompleksitas berbeda dengan meningkatkan tinggi dan lapisan struktur: silinder 7 lapis dan silinder 24 lapis (diameter 10 mm). (C) Struktur PLMA berbentuk bintang cetak 3D dengan kompleksitas berbeda dengan meningkatkan ukuran struktur: bintang 10 mm dan 20 mm (keduanya dengan 12 lapisan). (D) Penilaian pemulihan bentuk struktur silinder cetak 3D setelah kompresi. (E) Evaluasi kemampuan gantung dan retensi bentuk struktur cetak.
Hasil ini mengungkapkan bahwa kompleksitas struktur dan jalur cetak tidak memengaruhi kemampuan cetak. Hal ini dibuktikan dengan tinggi fidelitas (Gambar S6 ), yang merupakan perbandingan antara tinggi STL dan tinggi sebenarnya dari konstruksi yang dicetak, di mana konstruksi silinder dan bintang memiliki hasil yang serupa. Lebih jauh, kemampuan untuk mencetak konstruksi 24 lapis dapat membuktikan bahwa fotocrosslinking pasca-cetak berhasil digunakan dan bahwa struktur kompleks yang tinggi dan sempit dapat diperoleh dengan mudah, dengan nilai fidelitas pencetakan yang baik. Selain itu, fidelitas area dipertahankan terlepas dari strukturnya (Gambar S6J ). Keseragaman deposisi juga dinilai dengan mengukur keseragaman deposisi filamen pada ketinggian di seluruh lapisan struktur. Deposisi lapisan halus bahkan pada struktur yang lebih tinggi, lebih kompleks, dan lebih besar, terlepas dari bentuknya (Gambar S6K ), memperluas aplikasi potensial. Secara keseluruhan, kami dapat menghasilkan struktur yang kohesif dan kuat, membuktikan deposisi filamen tinta berbasis PLMA yang tepat dan cepat. Hal ini memastikan ketepatan cetak yang baik, sifat mekanis yang kuat, dan penerapan, seperti yang digambarkan pada Gambar 6D,E , yang memperlihatkan manipulasi struktur dan pemulihan bentuk setelah kompresi tanpa kehilangan sifat awalnya. Hal ini juga dapat dikonfirmasi oleh video pada Informasi Pendukung (Film S1 dan S2 ). Ini menunjukkan hasil yang sangat menjanjikan dan menggambarkan pendekatan yang sangat relevan untuk fabrikasi tinta granular dari biomaterial yang tidak dapat dicetak dengan penerapan yang luas.
Pendekatan kami mengeksplorasi responsivitas cahaya daripada teknik gelasi pasca-cetak untuk stabilisasi struktur [ 67 ]. Melalui metodologi ini, kami berhipotesis bahwa biomaterial berbasis alam lainnya dengan viskositas rendah, terutama yang berbasis protein, juga dapat diubah menjadi tinta yang dapat dicetak. Penggunaannya dan reproduktifitasnya dibuktikan dengan keberhasilan pencetakan struktur berbasis PLMA tanpa perlu menggabungkannya dengan polimer lain, seperti yang dilaporkan sebelumnya [ 33 , 41 , 42 ]. Khususnya, persyaratan tekanan rendah, yang dikaitkan dengan lebih sedikit tegangan geser, dapat memungkinkan enkapsulasi sel, memperluas penerapan. Ini adalah metode yang mudah dilakukan, namun efektif, yang dapat membuat tinta yang dapat disetel dari mikrogel yang dipilih. Hasil ini menguatkan yang sebelumnya ditemukan oleh penulis lain, yang menyimpulkan bahwa kemampuan cetak sebagian besar merupakan fungsi dari pengacauan, dan sampai batas tertentu, independen dari mikrogel penyusun [ 68 ]. Sebagaimana hal ini juga terungkap dalam perbandingan kami antara metodologi pengacauan, dalam kasus mikrogel berbasis BSAMA, ukuran dan sifat reologinya juga terungkap memengaruhi kemampuan cetak dan harus dioptimalkan lebih lanjut untuk reproduktifitas yang lebih baik.
2.4 Biokompatibilitas dan Efisiensi Enkapsulasi
Mikroporositas perancah granular memungkinkan infiltrasi sel ke dalam struktur hidrogel, yang bermanfaat untuk regenerasi jaringan [ 27 , 55 ]. Karena tinta granular biasanya diisi dengan sel, sangat penting untuk menilai biokompatibilitas tinta berbasis BSAMA dan PLMA. Untuk mengevaluasi hal ini, sel punca adiposa manusia (hASC) disemai di atas mikrogel yang difotosilang dan dikultur selama tujuh hari. Selama periode ini, aktivitas metabolisme sel diukur, dan analisis kualitatif proliferasi dan morfologi sel dilakukan.
Tren peningkatan aktivitas metabolik yang nyata dapat diamati pada kedua material seiring berjalannya waktu, seperti yang digambarkan pada Gambar 7A . Ada perbedaan statistik yang signifikan dalam aktivitas metabolik antara Hari 1 dan 7 untuk perancah berbasis BSAMA dan PLMA, serta antara Hari 3 dan 7 untuk perancah berbasis PLMA saja. Hasil menunjukkan tren peningkatan berkelanjutan dalam aktivitas metabolik dan nilai yang lebih tinggi untuk perancah PLMA pada semua hari. Penting juga untuk dicatat bahwa peningkatan aktivitas metabolik dapat dikaitkan dengan stres seluler daripada proliferasi saja [ 69 ]. Untuk memberikan wawasan lebih jauh, uji Hidup/Mati (pewarnaan kalsein/propidium iodida, masing-masing) dilakukan secara bersamaan. Seperti yang diilustrasikan pada Gambar 7D , ada peningkatan jumlah sel yang diwarnai hijau pada setiap titik waktu di kedua material. Hasil-hasil ini selanjutnya dikonfirmasi dengan mengukur intensitas fluoresensi sel-sel yang diwarnai kalsein, yang menunjukkan peningkatan terus-menerus setelah setiap titik waktu untuk kedua bahan, dengan intensitas fluoresensi yang lebih besar terungkap dalam perancah berbasis PLMA (Gambar 7B ). Lebih jauh lagi, terbukti bahwa sel-sel berhasil melekat pada perancah berbasis BSAMA dan PLMA sejak hari pertama dan bahwa hASC berkembang biak di sekitar dan di dalam ruang antara mikrogel yang diwarnai merah. Mikroporositas perancah granular berkontribusi pada kapasitas adsorpsi yang sangat baik, menghasilkan pewarnaan tidak hanya pada sel-sel tetapi juga perancah itu sendiri. Karena keberadaan sel-sel mati yang minimal dan autofluoresensi bahan-bahan, sulit untuk membedakan antara sel-sel fluoresensi dan perancah di saluran merah (Gambar 7D ). Untuk memberikan visualisasi yang lebih jelas, Gambar S7 menampilkan saluran terpisah untuk setiap titik waktu dari kedua bahan. Akhirnya, dengan mempertimbangkan jumlah kecil sel mati yang diamati, dapat disimpulkan bahwa tinta granular bersifat nonsitotoksik dan cocok untuk aplikasi biomedis.
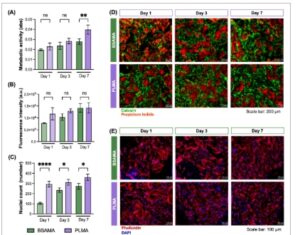
GAMBAR 7
Buka di penampil gambar
Presentasi PowerPoint
Evaluasi sitotoksisitas perancah granular dengan penyemaian hASC: (A) Aktivitas metabolik diukur dengan uji Alamar Blue ( n = 3); (B) Intensitas fluoresensi sel hidup yang diwarnai kalsein dari gambar hidup/mati; (C) Jumlah inti sel yang diwarnai DAPI. Semua analisis statistik dilakukan antara tinta dalam setiap titik waktu ( n = 3) menggunakan ANOVA dua arah. * p < 0,05, ** p < 0,01, dan **** p < 0,0001; (D) Gambar mikroskop fluoresensi dari uji hidup/mati. Skala batang: 200 µm; (E) Gambar mikroskop fluoresensi dari uji pewarnaan DAPI/Phalloidin. Skala batang: 100 µm.
Bahasa Indonesia : Untuk memberikan pengukuran proliferasi dan morfologi sel yang lebih akurat, jumlah sel (pengukuran tidak langsung) dan pewarnaan DAPI (4ʹ,6-diamidino-2-phenylindole)/phalloidin dilakukan (Gambar 7C,E , berturut-turut). Gambar S8 menunjukkan saluran terpisah untuk interpretasi hasil yang lebih jelas. Dari gambar-gambar ini, terlihat bahwa sel menunjukkan morfologi yang memanjang sejak Hari 1 di kedua bahan. Selain itu, ada juga peningkatan yang nyata dalam jumlah nuklei setelah setiap titik waktu di kedua bahan, yang mengonfirmasi proliferasi sel. Sekali lagi, ketika membandingkan perancah berbasis BSAMA dengan PLMA, jumlah nuklei yang lebih tinggi dapat diamati dalam perancah PLMA, konsisten dengan pengamatan sebelumnya dan menunjukkan biokinerja tinta PLMA yang lebih besar. Juga, terlihat bahwa sel dapat berkembang biak di ruang interstisial antara mikrogel penyusun tinta. Ini membuktikan porositas yang ada di dalam tinta yang memungkinkan infiltrasi sel. Penelitian lain menunjukkan kesulitan dalam memperoleh infiltrasi seluler, bahkan beberapa menambahkan komponen pengorbanan untuk menciptakan kembali fitur ini secara artifisial, bahkan ketika menggunakan tinta yang sifatnya serupa [ 70 ]. Selain itu, tekanan yang digunakan, terutama untuk tinta PLMA, dapat memastikan kelangsungan hidup sel yang tinggi selama pembuatan dan bioprinting, yang secara signifikan lebih rendah daripada tekanan yang dilaporkan dalam penelitian lain [ 68 ].
Ketika membandingkan aktivitas metabolik sel yang dikultur dalam kedua bahan pada setiap titik waktu, serta intensitas fluoresensinya, perbedaan di antara keduanya menjadi semakin jelas, yang menunjukkan kinerja PLMA yang unggul. Hal ini kemungkinan disebabkan oleh keberadaan berbagai faktor pertumbuhan dan molekul pensinyalan dalam PL, yang diketahui dapat meningkatkan adhesi dan proliferasi sel [ 71 , 72 ]. Sebaliknya, BSA tidak memiliki komponen bioaktif ini, sehingga kurang mendukung aktivitas seluler [ 71 , 73 ]. Penelitian sebelumnya dari kelompok penelitian kami menunjukkan bahwa perancah berbasis PLMA dapat mempertahankan pelepasan protein total, fibrinogen, dan faktor pertumbuhan endotel vaskular (VEGF), yang sangat penting dalam meningkatkan pemeliharaan sel selama pengujian kultur sel [ 38 , 47 , 74 ]. Pelepasan berkelanjutan ini menjelaskan kinerja unggul yang diamati dengan perancah berbasis PLMA, yang telah dimanfaatkan dalam penelitian lain dengan melengkapi tinta dengan PL atau faktor pertumbuhan turunan [ 45 , 67 , 73 ].
Mengingat hasil yang menjanjikan yang diperoleh pada uji penyemaian sel dan kemampuan cetak, kami telah melanjutkan untuk mengevaluasi potensi bahan kami sebagai biotinta. Gambar 8 menunjukkan alur kerja dan hasil evaluasi ini. Secara singkat, hASC dicampur dengan tinta yang telah disiapkan sebelumnya dan digunakan untuk mencetak kisi-kisi, yang di-fotocrosslinking pasca-pencetakan dan dikultur hingga 7 hari. Untuk prosedur ini, NJ dilakukan sebelum pencampuran sel untuk menghindari pembuangan sel yang dienkapsulasi selama pengacauan. Ini menjelaskan langkah tambahan yang dapat membuat persiapan lebih memakan waktu, sehingga menghambat kelayakan. Kemungkinan lain untuk menyiapkan biotinta adalah dengan melakukan enkapsulasi sel di dalam mikrogel daripada di ruang interstisial, seperti yang dijelaskan sebelumnya dalam literatur [ 75 ].
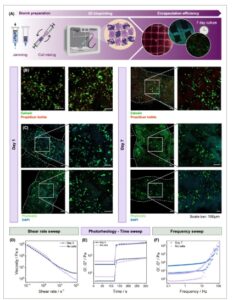
GAMBAR 8
Buka di penampil gambar
Presentasi PowerPoint
Biokompatibilitas dan efikasi enkapsulasi hASC dalam biotinta berbasis PLMA (A) Alur kerja bioprinting. (B) Gambar mikroskop fluoresensi dari uji hidup/mati. Skala batang: 100 µm. (C) Gambar mikroskop fluoresensi dari uji pewarnaan DAPI/Phalloidin. Skala batang: 100 µm. (D) Uji laju geser untuk viskositas dan perilaku pengenceran geser biotinta PLMA-NJ dan kontrol tanpa sel. (E) Uji waktu fotoreologi biotinta PLMA-NJ dan kontrol tanpa sel. (F) Uji frekuensi sapuan biotinta PLMA-NJ setelah 7 hari kultur dan kontrol tanpa sel. Skema dibuat dengan Biorender.
Hasil uji hidup/mati (Gambar 8B ) menunjukkan beberapa kematian sel setelah 24 jam pertama kultur, respons awal yang diharapkan terhadap tekanan geser terkait pencetakan dan kerangka waktu persiapan bioink [ 76 ]. Selain itu, beberapa EDC dan NHS yang tidak bereaksi yang tersisa dari ikatan silang kimia dapat larut, menyebabkan toksisitas awal ini. Meskipun demikian, pada Hari ke-7 kultur, mikrograf mereka menunjukkan kematian sel yang dapat diabaikan serta sejumlah besar sel menyebar ke seluruh filamen. Ini adalah bukti efisiensi enkapsulasi tinta ini dan kemampuannya untuk mendukung pertumbuhan dan proliferasi sel hingga tujuh hari setelah bioprinting. Kami selanjutnya mengevaluasi distribusi dan morfologi sel dengan melakukan pewarnaan DAPI/Phalloidin (Gambar 8C ), yang menggambarkan penampang dan perbesaran pada filamen kisi-kisi bioprinting. Pada Hari 1 dan 7, sel-sel tersebar secara seragam dalam biotinta, terus menerus mengisi ruang interstisial di antara mikrogel. Juga, perlu dicatat bahwa dengan menggunakan biotinta ini, kami dapat mencetak kisi-kisi yang dapat ditangani dan dikultur hingga tujuh hari dengan kesetiaan cetakan dan retensi bentuk yang sangat baik. Hal ini dirasakan oleh filamen yang digariskan pada Gambar 8B,C . Kami tidak melihat peningkatan jumlah sel seiring waktu, yang mungkin juga terkait dengan kematian sel yang diamati setelah 24 jam pertama kultur. Secara keseluruhan, hasil ini menunjukkan bahwa biotinta PLMA-NJ telah secara efisien membungkus hASC, menunjukkan kesetiaan bentuk dan viabilitas yang hebat, mirip dengan laporan lain yang menggunakan biotinta granular [ 77 , 78 ]. Selain itu, bertentangan dengan pendekatan lain, sifat bioaktif dari tinta ini memberikan hasil yang lebih baik secara keseluruhan, memenuhi kesenjangan literatur [ 79 , 80 ].
Gambar 8D–F menggambarkan karakterisasi reologi dari biotinta, termasuk penilaian viskometri melalui sapuan laju geser, sapuan waktu fotoreologi, dan sapuan frekuensi, masing-masing. Sapuan laju geser dan waktu dilakukan pada biotinta PLMA-NJ yang baru disiapkan, dan kontrol tanpa sel juga dinilai untuk formulasi tinta yang sama. Sapuan frekuensi dilakukan pada biotinta PLMA-NJ yang difoto-silang setelah 7 hari kultur, di samping kontrol, yang juga difoto-silang tetapi tidak dikultur dengan sel. Dari Gambar 8D kita dapat melihat bahwa formulasi biotinta masih mempertahankan sifat pengenceran geser tinta, yang sangat penting untuk ekstrusinya. Gambar 8E menunjukkan bahwa kemampuan foto-silangnya tidak terpengaruh, meskipun modulus awal biotinta lebih rendah daripada tanpa penyertaan sel. Namun, modulus biotinta setelah foto-silang tetap tidak berubah dalam formulasi biotinta. Gambar 8F menunjukkan bahwa setelah 7 hari kultur, biotinta menunjukkan stabilitas dan ketergantungan frekuensi yang sama terhadap perancah jika dibandingkan dengan kontrol tanpa sel dan tidak dimasukkan ke dalam kondisi kultur sel. Secara keseluruhan, kami dapat menyimpulkan bahwa penambahan sel tidak membahayakan sifat reologi tinta.
Hasil-hasil ini menunjukkan biokompatibilitas yang sangat baik dari tinta granular ini serta kelayakan dan penggunaannya dalam bioprinting 3D terhadap berbagai pendekatan rekayasa jaringan, seperti yang dilaporkan sebelumnya [ 81 ]. Hasil-hasil ini memperluas potensi penerapan tinta ini. Secara keseluruhan, tinta ini terbukti dapat direproduksi dan mudah diperoleh, menunjukkan bioaktivitas dan kemampuan cetak yang tinggi, mampu mempertahankan proliferasi sel dan mempertahankan bentuk bioprint tanpa harus menggunakan bak pendukung, seperti yang dilaporkan dalam penelitian lain [ 82 ].
2.5 Penerapan Tinta Granular—Modularitas dan Kapasitas Enkapsulasi Obat
Salah satu keuntungan besar menggunakan tinta granular adalah modularitasnya, yang memungkinkan konsepsi hidrogel multi-responsif. Untuk menunjukkan modularitas ini, kami mewarnai hidrogel prekursor berbasis PLMA dengan fluorofor yang berbeda (1,1-dioctadecyl-3,3,3,3-tetramethylindodicarbocyanine, 4-chlorobenzenesulfonate salt [DiD], DAPI, dan 3,3ʹ-dioctadecyloxacarbocyanine perchlorate [DiO]) sebelum fragmentasi mekanis untuk produksi mikrogel. Mikrogel yang diwarnai ini kemudian dicampur dan dijepit untuk membentuk tinta granular. Seperti yang digambarkan dalam Gambar 9A , filamen yang diekstrusi menunjukkan mikrogel yang diwarnai dengan fluorofor yang berbeda yang didistribusikan secara acak dalam seluruh filamen, yang menunjukkan sifat modular dari tinta granular kami. Kami menyertakan saluran fluoresensi terpisah dalam Gambar S9 untuk penilaian terperinci. Menggabungkan populasi mikrogel diskret yang terbuat dari polimer berbeda yang mencampur mikrogel yang mengandung lini sel atau obat berbeda, atau kombinasi keduanya, dapat memerlukan penerapan yang luas [ 70 , 83 , 84 ]. Ini dapat menjadi sangat penting untuk aplikasi regenerasi jaringan, karena memungkinkan sel punca dan biomolekul yang membantu diferensiasi sel untuk dienkapsulasi dalam mikrogel terpisah. Modularitas ini juga dapat digunakan sebagai bahan pengorbanan untuk membuat pori-pori setelah pencetakan perancah dengan menggunakan mikrogel dengan degradasi cepat [ 70 ]. Lebih lanjut, pendekatan ini juga dapat digunakan untuk meningkatkan sifat reologi tinta yang tidak memiliki persyaratan untuk pencetakan dengan menggabungkan mikrogel untuk sifat dan penerapan yang lebih diinginkan [ 59 ]. Sebuah studi baru-baru ini juga menunjukkan pentingnya modularitas dengan menggabungkan mikrogel lunak (0,5 kPa) dan kaku (13,5 kPa) dalam rasio yang berbeda untuk menilai adhesi dan proliferasi fibroblas [ 85 ]. Fibroblas menunjukkan peningkatan daya rekat pada mikrogel kaku, yang menyebabkan peningkatan proliferasi dalam rasio dengan proporsi mikrogel kaku yang lebih tinggi. Meskipun demikian, keberadaan mikrogel lunak juga penting, karena dapat memfasilitasi proses pencetakan.
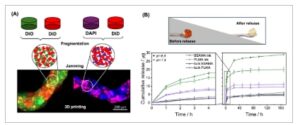
GAMBAR 9
Buka di penampil gambar
Presentasi PowerPoint
(A) Penilaian modularitas tinta granular: pencampuran mikrogel PLMA yang diwarnai dengan fluorofor yang berbeda dengan gambar confocal filamen yang diekstrusi. (B) Kapasitas enkapsulasi obat dari tinta granular: penyerapan naringin dan pelepasan pada suhu 37°C dan kondisi pH 6,5 (asam) dan 7,4 (netral) dengan analisis statistik. p < 0,0001.
Bahasa Indonesia: Untuk lebih jauh menunjukkan penerapan yang lebih luas dari tinta ini, kami mengujinya sebagai wahana penghantaran obat, yang menyediakan wawasan penting tentang enkapsulasi obat dan profil pelepasan. Perancah granular berbasis BSAMA dan PLMA, serta perancah curah (kondisi kontrol), dimuat dengan naringin, flavonoid yang dikenal karena sifat diferensiasi selnya [ 86 , 87 ]. Kita dapat melihat dari Gambar 9B bahwa naringin berhasil terperangkap ke perancah granular setelah perendamannya dalam larutan flavonoid, dan kedua bahan menunjukkan pelepasan obat dalam kondisi fisiologis dan asam. Perancah granular berbasis BSAMA menunjukkan kapasitas enkapsulasi dan pelepasan kumulatif terbaik, mencapai 20 µg pada pH 7,4 setelah 7 hari. Dalam kondisi dan jangka waktu yang sama, perancah berbasis PLMA melepaskan 9,5 µg, yang berarti tinta berbasis BSAMA dapat memiliki kapasitas pelepasan hingga dua kali lipat. Lebih jauh, dalam 4 jam pertama, tinta berbasis BSAMA telah melepaskan 75,5% dari total kumulatifnya, dan tinta berbasis PLMA 80%. Hal ini menunjukkan tingkat pelepasan yang berbeda dan oleh karena itu potensi penyetelan dan penerapan. Kami mengaitkan perbedaan antara berbasis BSAMA dan PLMA ini dengan mikroporositas tinta berbasis BSAMA yang lebih besar, seperti yang dinilai sebelumnya. Jika dibandingkan dengan kontrol massal, jelas bahwa mikroporositas bawaan tinta granular memungkinkan peningkatan enkapsulasi obat dan kapasitas pelepasannya. Dalam kondisi yang sama, kontrol melepaskan total 5,1 dan 6,5 µg untuk perancah massal berbasis BSAMA dan PLMA. Ini berarti bahwa tinta granular dapat merangkum dan melepaskan 292,2% dan 53,2% lebih banyak naringin daripada kontrol massal, masing-masing. Dalam kondisi asam, scaffold granular berbasis BSAMA dan PLMA melepaskan 45% dan 16,8% lebih banyak naringin setelah tujuh hari, dibandingkan dengan pelepasan yang dilakukan dalam kondisi fisiologis (pH 7,4). Kecenderungan ini tidak terlihat pada kontrol massal.
Hasil-hasil ini menunjukkan potensi aplikasi formulasi-formulasi ini dalam berbagai lingkungan dan kondisi dalam tubuh manusia, seperti tumor atau ceruk regeneratif [ 88 ]. Lebih lanjut, tinta granular berbasis BSAMA dapat cocok untuk pelepasan yang lebih cepat dan dalam jumlah besar. Dalam konteks regenerasi tulang, misalnya, dilaporkan bahwa pelepasan BMP-2 yang cepat, diikuti oleh pelepasan berkelanjutan, terbukti penting dalam proses penyembuhan tulang. Di sisi lain, tinta berbasis PLMA dapat lebih cocok untuk pelepasan molekul tertentu yang terkontrol. Ini dapat sangat menguntungkan untuk perbaikan tulang rawan karena merupakan proses yang lambat yang diuntungkan oleh pelepasan molekul bioaktif yang berkelanjutan untuk meningkatkan kondrogenesis dan sintesis matriks ekstraseluler. Modularitas bawaan tinta granular dengan demikian memungkinkan penyetelan profil pelepasan dan sifat-sifat lainnya untuk memenuhi persyaratan khusus dari berbagai aplikasi rekayasa jaringan. Fleksibilitas ini menjadikan tinta granular sebagai platform serbaguna untuk menyesuaikan sistem pengiriman terapeutik. Tinta granular telah digunakan sebagai terapi yang dapat disuntikkan, dan penelitian lain telah menunjukkan bahwa hasil reologi dan pencetakan yang dicapai oleh tinta ini sangat penting untuk aplikasi tersebut, yang juga dapat menunjukkan penerapan lebih lanjut dari tinta yang diproduksi di sini mengenai karya saat ini [ 24 , 81 , 89 , 90 ].
3 Kesimpulan
Singkatnya, kami berhasil mengembangkan biotinta granular untuk pencetakan 3D ekstrusi menggunakan komponen yang berasal dari darah yang jika tidak, memiliki viskositas rendah dan tidak dapat dicetak. Metodologi yang disajikan di sini menunjukkan alternatif penting untuk penggunaan polimer sintetis, pengental, atau adjuvan berbobot molekul tinggi, yang membuka berbagai kemungkinan untuk penggunaannya dalam beberapa aplikasi biomedis lainnya. Lebih jauh, tinta ini menunjukkan mikroporositas dan sifat reologi yang diinginkan untuk pencetakan, serta kemampuan untuk membentuk filamen yang stabil melalui ekstrusi. Yang terpenting, kami memberikan wawasan yang signifikan tentang hasil proses pengacauan mikrogel berbasis protein yang terikat silang secara kovalen pada sifat dan kemampuan cetaknya. NJ ditemukan sebagai yang paling cocok untuk biomaterial ini untuk menghasilkan formulasi pengenceran geser yang cocok untuk pencetakan 3D ekstrusi, dibandingkan dengan CJ yang ditetapkan secara konvensional. Filamen cetak, perancah grid, dan struktur berbelit-belit menunjukkan fidelitas cetak dan integritas struktural yang baik tanpa memerlukan bak pendukung. Selain itu, hASC berkembang biak di ruang interstisial mikrogel saat disemai dalam perancah fabrikasi dan saat dienkapsulasi dalam formulasi biotinta. Mengingat sifat tinta yang terbukti bioaktif dan kaya faktor pertumbuhan, tidak diperlukan adjuvan untuk kultur sel. Secara keseluruhan, tinta granular PLMA menunjukkan kinerja yang unggul dalam hal kemampuan alir dan kemampuan cetak, serta fitur pendukung sel. Lebih jauh lagi, modularitas tinta dan fitur pemuatan/pelepasan obatnya memperluas aplikasi biomedisnya. Tinta ini terungkap memiliki reproduktifitas dan biofungsionalitas yang sangat baik, yang selanjutnya memerlukan kemampuan untuk mengenkapsulasi obat dan membuat konstruksi yang kompleks, dipersonalisasi, dan spesifik pasien untuk rekayasa jaringan dan terapi menggunakan teknik pencetakan 3D ekstrusi dan pengacauan yang terjangkau.
4 Bagian Eksperimen
Metakrilasi BSA : Metakrilasi dilakukan dengan menggunakan metodologi yang sebelumnya dioptimalkan oleh kelompok kami [ 91 ]. Awalnya, BSA (5 wt%) dilarutkan dalam larutan buffer NaHCO 3 /Na 2 CO 3 pH 9 pada suhu 37°C. Kemudian, MA (1% v/v) ditambahkan perlahan-lahan, dan campuran diaduk pada suhu 37°C selama 1 jam. Setelah itu, pH disesuaikan menjadi pH 7,4 dan dibiarkan dalam dialisis selama 48 jam dalam air deionisasi untuk menghilangkan MA yang tidak bereaksi. Akhirnya, BSAMA dibekukan selama 7 hari dan disimpan pada suhu 4°C.
Metakrilasi PL : PLMA disediakan oleh Metatissue (Ílhavo, Portugal) dalam lingkup perjanjian hibah InterLynk H2020 (lihat bagian ucapan terima kasih).
Penilaian derajat modifikasi : Spektrum 1 H-NMR dari BSA, BSAMA, PL, dan PLMA diperoleh dengan melarutkan protein pada 10 mg/mL dalam dimetil sulfoksida (DMSO) 99,5% (Fisher Scientific, AS) dan memipet 500 µL ke dalam tabung NMR, kemudian dipindai pada 300,13 MHz, penundaan relaksasi 18 detik, dan 512 pemindaian (AMX-300, Bruker, Jerman). Spektrum yang diperoleh dianalisis dengan perangkat lunak MestreNova. Derajat modifikasi dihitung dengan membagi jumlah luas di bawah puncak yang berkaitan dengan gugus metakrilat ( δ ≈ 5,27–5,63 ppm) dengan luas di bawah puncak yang berkaitan dengan gugus aromatik ( δ ≈ 7,22 ppm), seperti yang dijelaskan sebelumnya dalam kelompok [ 91 ].
Produksi hidrogel massal : Larutan protein disiapkan secara terpisah dengan penambahan protein dalam rasio 1:1, seperti yang sebelumnya dioptimalkan oleh kelompok penelitian kami [ 47 ]. Awalnya, larutan 10 wt% BSA dan BSAMA dan larutan 20 wt% PL dan PLMA dilarutkan dalam PBS. Pada langkah ini, fotoinisiator Litium fenil-2,4,6-trimetilbenzoilfosfinat (LAP) ditambahkan ke larutan BSA dan PL yang tidak dimodifikasi pada 0–5 wt%. Untuk kemudian mengubah larutan cair ini menjadi hidrogel, larutan EDC (100 wt%) dan NHS (25 wt%) dalam PBS ditambahkan pada konsentrasi 2,75% v/v untuk hidrogel massal berbasis BSA dan 6,00% v/v untuk berbasis PL. Rasio massa EDC:NHS yang digunakan adalah 1:0,25. Untuk memastikan ikatan silang yang homogen, larutan ditempatkan dalam thermomixer selama 3 jam pada kecepatan 1000 rpm dan suhu 37°C. Untuk menghasilkan tinta berwarna, fluorofor fluorescein isothiocyanate-labeled bovine serum albumin (BSA-FITC), DiO, DiD, dan DAPI ditambahkan ke dalam larutan awal pada 0,5% v/v.
Pembuatan mikrogel : Untuk membuat mikrogel, digunakan metode fragmentasi mekanis dengan ekstrusi. Hidrogel curah dimasukkan ke dalam spuit 5 mL dan diekstrusi melalui jarum berukuran 18, 21, dan 23 sebanyak lima kali untuk setiap jarum, dari jarum berdiameter terbesar hingga terkecil.
Pencitraan mikrogel : Mikrogel yang diwarnai BSA-FITC didispersikan dalam PBS dan ditambahkan ke dalam ruang μ-Slide 8-sumur dan diamati di bawah mikroskop confocal pemindaian laser resolusi tinggi (LSM 900, Carl Zeiss, Jerman).
Pembuatan tinta granular : Untuk tinta yang diproses dengan CJ, mikrogel disentrifugasi dalam unit filter sentrifugal Amicon Ultra 50 mL (MilliporeSigma) pada 3750 × g selama 25 menit, RT. Untuk yang diproses dengan NJ, kelebihan air diekstrusi dari bubur mikrogel dengan bioprinter (CELLINK Bioprinting AB, Swedia) dalam kartrid 3 mL dengan nosel 22 G. Mikrogel dalam tinta bernoda dicampur sebelum proses pengadukan. Hasil produksi tinta granular dihitung sebagai rasio massa akhir mikrogel yang diperoleh setelah sentrifugasi hidrogel massal yang terfragmentasi dengan massa awal hidrogel massal yang digunakan pada awal proses fabrikasi.
Penentuan porositas : Kuantifikasi porositas dilakukan melalui infiltrasi pewarna berdasarkan metodologi yang dijelaskan sebelumnya [ 31 , 56 ]. Untuk memungkinkan evaluasi mikroporositas antara mikrogel, hidrogel curah juga digunakan sehingga nilai nanoporositas tidak diperhitungkan. 100 µL tinta granular dan hidrogel curah ditempatkan di bagian bawah spuit 1 mL. Kemudian, 100 µL pewarna ditambahkan di atasnya, dan jumlah pewarna yang menyusup ke dalam struktur setelah 24 jam pengujian dikuantifikasi. Mikroporositas dihitung dengan mengurangi persentase pewarna yang menyusup ke dalam hidrogel curah dari nilai untuk tinta granular:

Karakterisasi reologi : Sifat reologi dianalisis menggunakan rheometer Kinexus Lab + (Malvern Panalytical, Inggris) dengan geometri bidang 8 mm dan celah 0,5 mm. Untuk menentukan daerah viskoelastis linear dan regangan luluh, uji sapuan regangan dilakukan dalam kisaran 0,05% hingga 500% pada 1 Hz. Untuk fotoreologi, uji sapuan waktu pada regangan rendah (0,5%) dan frekuensi (1 Hz) dengan paparan cahaya dengan lampu internal pada 2,5 W/cm2 ( seri OmniCure S, Excelitas, AS) dilakukan selama total 5 menit. Dengan awal paparan cahaya setelah 2 menit. Penipisan geser dievaluasi menggunakan ramp laju geser dalam kisaran laju geser 0,1 hingga 100 s −1 . Uji sapuan frekuensi juga dilakukan sebelum dan sesudah fotocrosslinking dari 0,01 hingga 100 Hz pada regangan rendah 0,5%. Semua sampel dikenakan metode crosslinking pertama dengan kopling kimia EDC/NHS, seperti yang dijelaskan sebelumnya. Formulasi tinta diproses seperti yang dijelaskan sebelumnya. Untuk formulasi massal, retikulasi dilakukan dalam cetakan PDMS berdiameter 8 mm dan tidak dikenakan fragmentasi mekanis. Biotinta PLMA-NJ disiapkan seperti yang dijelaskan sebelumnya dengan penambahan 10 juta hASC dalam 10 µL media per mililiter tinta. Perancah granular biotinta PLMA-NJ yang dienkapsulasi sel, dikultur selama tujuh hari, disiapkan dengan metode yang sama dan difotocrosslinking dalam cetakan PDMS 8 mm. Selain untuk uji fotoreologi dan sapuan frekuensi pasca-fotocrosslinking, semua formulasi tidak terkena cahaya.
Kapasitas enkapsulasi dan pelepasan naringin : Untuk memungkinkan penentuan naringin menggunakan spektroskopi UV-vis, naringin (50 mg dalam 0,5 mL dimetil sulfoksida) direaksikan dengan difenil asam borat 2-aminoetil ester (DPBA) (39 mg dalam 1,0 mL etanol) untuk membentuk kompleks yang lebih stabil. Kemudian, perancah massal dan granular berbasis BSA dan PL direndam dalam 1 mL larutan flavonoid encer (1000 ppm) selama 24 jam, diikuti dengan langkah pencucian untuk menghilangkan kelebihan naringin. Uji pelepasan naringin dilakukan di bawah bak pengocok pada suhu 37°C pada pH 6,5 dan 7,4 selama 7 hari. Jumlah naringin yang dienkapsulasi diukur dengan menganalisis spektrum UV-tampak larutan pada panjang gelombang 280 nm sebelum dan sesudah perendaman. Jumlah naringin yang dilepaskan pada setiap titik waktu ditentukan melalui prosedur yang sama.
Pencetakan ekstrusi 3D (bio) : Struktur dengan geometri berbeda dicetak menggunakan bioprinter BIOX (CELLINK Bioprinting AB, Swedia). Tinta granular ditambahkan dalam kartrid 3 mL dan dicetak menggunakan nosel 22G pada kecepatan berkisar dari 2 hingga 16 mm/s dan tekanan berkisar dari 20 hingga 30 kPa untuk PLMA-NJ dan 40 hingga 75 kPa untuk BSAMA-NJ, dan sekitar 30 kPa untuk PLMA-CJ dan 120 kPa untuk BSAMA-CJ. Perancah tersebut difotosilang menggunakan cahaya pada panjang gelombang 405 nm (25 mW/cm 2 ) selama 20 detik setelah setiap pencetakan lapisan melalui kepala alat fotocuring (CELLINK). Pencetakan 3D tanpa enkapsulasi sel dilakukan dalam cawan Petri bulat 90 mm, dan pencetakan bio 3D dilakukan dalam pelat kultur sel 6-sumur.
Penilaian kemampuan cetak : Untuk mengevaluasi kemampuan cetak tinta yang dikembangkan, terdapat filamen cetak, kisi, dan konstruksi berbentuk silinder dan bintang. Dari gambar mikroskopi filamen cetak, diameter filamen, jarak untai, dan rasio keseragaman filamen diukur dan/atau dihitung. Diameter filamen dihitung sebagai diameter rata-rata dari 20 pengukuran di tiga filamen berbeda. Jarak untai dihitung sebagai rata-rata dari 20 pengukuran jarak antara filamen. Rasio keseragaman filamen dihitung dengan membagi panjang filamen dengan rata-rata dari 20 pengukuran keliling filamen yang dihitung dengan membagi keliling filamen cetak dengan panjangnya. Dari gambar mikroskopi kisi cetak, rasio luas kisi, faktor pori, dan patahan kisi juga dinilai/dihitung. Rasio luas kisi dihitung dengan membagi luas kisi cetak dengan luas STL. Faktor pori dihitung dengan membagi pangkat dua keliling pori dengan perkalian 16 dengan luas pori. Pemutusan grid berhubungan dengan berapa kali terjadi interupsi pengendapan filamen pada grid yang dicetak. Dari konstruksi yang dicetak, citra mikroskopi, kesetiaan tinggi, kesetiaan area, dan keseragaman pengendapan dievaluasi. Kesetiaan tinggi dihitung dengan membagi rata-rata 20 pengukuran tinggi konstruksi (dari citra mikroskopi tampak samping) dengan tinggi teoritis STL. Kesetiaan area struktur dihitung dengan membagi area konstruksi yang dicetak (dari lapisan terakhir citra mikroskopi tampak atas) dengan area teoritis STL. Keseragaman pengendapan dihitung dengan membagi keliling lapisan yang dicetak dalam tinggi (dari citra mikroskopi tampak samping) dengan tinggi konstruksi.
Kultur sel, penyemaian, dan enkapsulasi bioink : Kinerja biologis tinta granular berbasis BSA dan PL dievaluasi menggunakan sel punca adiposa primer manusia (hASC) yang diisolasi secara internal antara Passage 4 dan 8. Sel-sel dikultur dalam α-MEM (Thermo Fisher Scientific, AS) yang dilengkapi dengan 10% v/v serum sapi fetal (Thermo Fisher Scientific, AS) dan 1% v/v antibiotik (Thermo Fisher Scientific, AS), dan medium diganti setiap 3 hari. Sel dan eksperimen dipelihara dalam inkubator dengan atmosfer CO2 5% pada suhu 37°C. Penyemaian hidrogel dilakukan dengan sel yang mencapai 80% sub-konfluensi. Untuk eksperimen ini, larutan awal steril PL, PLMA, BSA, dan BSAMA digunakan, dan produksi tinta granular dilakukan dalam lemari pengaman biologis Kelas II untuk menjaga sterilitas. Perancah silinder diproduksi dengan cara menuang tinta ke dalam cetakan PDMS silinder berdiameter 6 mm. Setelah itu, perancah distabilkan melalui foto-silang dan dipertahankan dalam media kultur selama 24 jam. Sebelum ditempatkan dalam pelat 96-sumur yang tidak melekat, perancah dicuci dengan DPBS. Suspensi sel diproduksi dengan tripsinisasi (larutan tripsin/EDTA, Sigma-Aldrich, Jerman), dan 5 × 104 sel diendapkan di atas setiap perancah. Sel-sel dipertahankan dalam kultur selama 7 hari, dan media kultur ditukar setelah hari pengujian ketiga. Untuk formulasi biotinta PLMA-NJ, tinta disiapkan seperti yang dijelaskan sebelumnya dengan penambahan 10 juta hASC per mililiter tinta. Sel-sel dienkapsulasi dalam tinta dengan mencampur sel dan tinta dari jarum suntik ke jarum suntik (seperti yang ditampilkan pada Gambar 8A ).
Aktivitas metabolik : Sitotoksisitas tinta dan proliferasi seluler hASC dievaluasi dengan menggunakan uji Viabilitas Sel AlamarBlue. Aktivitas metabolik ditentukan pada hari ke-1, ke-3, dan ke-7. Secara singkat, perancah dicuci dalam dPBS selama 5 menit dan kemudian ditempatkan dalam larutan 10% v/v alamarBlue dalam α-MEM. Perancah diinkubasi dalam larutan ini selama 5 jam, dan absorbansi diukur pada panjang gelombang 570 dan 600 nm (Multimodal microplate Reader—Synergy HTX dengan luminesensi, fluoresensi, dan absorbansi, Biotek, AS).
Uji Hidup/Mati : Pada Hari ke-1, ke-3, dan ke-7 kultur, perancah dicuci dalam dPBS selama 5 menit dan diinkubasi dalam larutan 2 µL kalsein AM (Thermo Fisher Scientific, AS) dan 1 µL propidium iodida (Thermo Fisher Scientific, AS) dalam 1 mL dPBS. Perancah diinkubasi selama 30 menit pada suhu 37°C, dicuci tiga kali dalam dPBS, dan dievaluasi dalam mikroskop fluoresensi (Zeiss Axio Imager M2, Zeiss, Jerman).
Morfologi sel dan penghitungan inti : Morfologi hASC yang disemai di atas perancah tinta dievaluasi dengan pewarnaan DAPI/phalloidin. Pada Hari ke-1, ke-3, dan ke-7 kultur, perancah dicuci dalam dPBS selama 5 menit dan difiksasi menggunakan larutan paraformaldehida 4% selama 1 jam, diikuti oleh siklus pencucian dPBS lainnya. Setelah itu, perancah diinkubasi dalam larutan DAPI (1 µL dalam 1000 µL dPBS) selama 30 menit pada suhu ruangan. Perancah kemudian dimasukkan lagi ke dalam dua siklus pencucian lainnya dan diinkubasi dalam larutan phalloidin (5 µL dalam 1000 µL dPBS) selama 45 menit. Akhirnya, perancah dicuci tiga kali terakhir dan diamati di bawah mikroskop fluoresensi (Zeiss Axio Imager M2, Zeiss, Jerman). Gambar fluoresensi digunakan untuk mengukur jumlah inti pada setiap titik waktu dengan menghitung inti pada setiap gambar dan menghitung rata-rata di semua gambar.
Analisis Statistik : Data disajikan sebagai rata-rata ± simpangan baku untuk percobaan dengan setidaknya tiga pengujian independen. Analisis statistik dilakukan dengan GraphPad Prism 10 (GraphPad Software, California, AS) menggunakan analisis varians satu arah (ANOVA) dan uji Tukey untuk penilaian post hoc perbedaan antar sampel. Signifikansi statistik didefinisikan sebagai * p < 0,05, ** p < 0,01, *** p < 0,001, **** p < 0,0001, ns = tidak signifikan,